
【题目】下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1molL-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1molL-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3)
C.向0.2molL-1NaHCO3溶液中加入等体积0.1molL-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1molL-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤B. ③C. ③④⑥D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验:
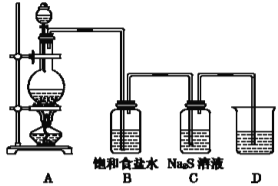
(1)装置A中制取的物质是___,化学方程式___。
(2)装置B的作用是___;C中的现象是___,离子方程式___,由此说明非金属性的强弱顺序是__。
(3)D中盛装的溶液是___,作用是___,离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是

A. x=4
B. 若N中气体的密度如图Ⅲ所示,则A、B可能都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2-具有相同的电子层结构。下列说法正确的是
A.Y与氢元素所形成的化合物分子中只含有极性键
B.W2Y、W2Y2中阴、阳离子个数比均为1∶2
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。则下列说法不正确的是( )
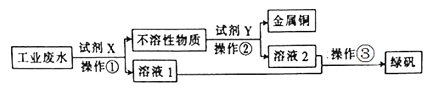
A.试剂X为铁粉
B.试剂Y为稀盐酸,操作②是过滤
C.操作③是:蒸发浓缩,冷却结晶,过滤
D.可用K3Fe(CN)6溶液来检验“溶液1”中的主要阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W原子序数依次增大,其中Y是构成物质种类最多的一种元素。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙是其中三种元素对应的单质,m的自述是“诞生在闪电的弧光中,强大的能量造就了我”。n能使湿润的红色石蕊试纸变蓝。上述物质的转化关系如图所示(反应条件已略去)。下列说法正确的是

A. 常温常压下,X与Y组成的化合物一定为气体
B. X、Z、W三种元素不能组成离子化合物
C. 原子半径:X<W<Y<Z
D. 图示转化关系中涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时,各微粒浓度占总微粒浓度之和的分数
平衡时,各微粒浓度占总微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是![]()
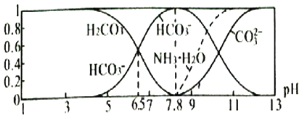
A.当![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
![]()
B.![]() 溶液中存在下列关系:
溶液中存在下列关系: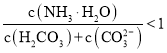
C.向![]() 的上述溶液中逐滴滴加氢氧化钠溶液时,
的上述溶液中逐滴滴加氢氧化钠溶液时,![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.分析可知,常温下水解平衡常数![]() 的数量级为
的数量级为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com