
| A、若Y最高价为+5,则X最高价一定为+6或+7 |
| B、若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
| C、若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 |
| D、X的离子半径一定比Y离子半径小 |


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
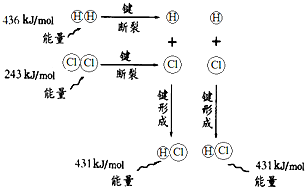
| A、H2(g)和Cl2(g)反应生成HCl(g)是吸热反应 |
| B、2个H原子结合生成一个H2分子时放出436kJ能量 |
| C、1molHCl(g)分子中的化学键断裂时需要吸收862kJ能量 |
| D、H2(g)+Cl2(g)═2HCl(g)的反应热△H=-183kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C、由C(石墨)═C(金刚石)△H=+1.90 kJ?mol-1可知,金刚石比石墨稳定 |
| D、500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成0.2molNH3(g),放热9.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化合物中呈+2价 |
| B、氢氧化物呈两性 |
| C、单质与水反应,放出氢气 |
| D、碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
14 7 |
18 8 |
| A、质量和分子数相同 |
| B、若压强相同,则含有相同的质子数,但质量不同 |
| C、质量和分子数都不相同 |
| D、若压强相同,则含有相同的原子、质子、中子和电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
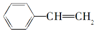
| A、易溶于水,不易溶于有机溶剂 |
| B、在空气中燃烧产生黑烟 |
| C、能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色 |
| D、能发生加成反应,在一定条件下可与4倍物质的量的氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫通入NaOH溶液至过量:SO2+OH-=HSO3- |
| B、氯化铵溶液溶解少量氢氧化镁固体:2NH4++Mg(OH)2=Mg2++2NH3?H2O |
| C、硫酸氢钠溶液与足量氢氧化钡溶液反应:SO42-+Ba2++2H++2OH-=BaSO4↓+2H2O |
| D、铁粉溶于足量稀硝酸:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铜丝放入氯化铁溶液中 |
| A、上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
| B、实验①中铁钉只作还原剂 |
| C、实验②中Fe2+既显氧化性又显还原性 |
| D、实验③中发生的是置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com