
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
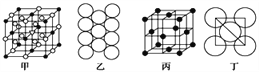
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
【答案】 Na3AlF6 共价键、配位键 H2O V形 sp3 F ![]() Na+ 4
Na+ 4 ![]()
【解析】(1)冰晶石的成分是Na3AlF6,该物质中Na+和AlF6-之间存在离子键,Al原子和F原子之间存在配位键和共价键,故答案为:Na3AlF6;共价键和配位键;
(2)H2O中含有10个电子,水分子中含有2个共价单键和2个孤电子对,所以其空间构型为V形,O原子采用杂化,故答案为:H2O;V形;sp3;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为![]() ,故答案为:F;
,故答案为:F;![]() ;
;
(4)●的个数=8×![]() +6×
+6×![]() =4,○个数=12×
=4,○个数=12×![]() +8+1=12,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,故答案为:Na+;
+8+1=12,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,故答案为:Na+;
(5)该晶胞中Al原子个数=8×![]() +6×
+6×![]() =4,该晶胞棱长=
=4,该晶胞棱长= =2
=2![]() d,所以晶胞的体积=(2
d,所以晶胞的体积=(2![]() d)3,ρ=
d)3,ρ=![]() =
= =
=![]() ,故答案为:4;
,故答案为:4; ![]() 。
。


科目:高中化学 来源: 题型:
【题目】用乙烯和乙醇为原料制取草酸二乙酯的过程中发生的反应类型及顺序正确的是
①酯化反应 ②氧化反应 ③水解反应 ④加成反应
A. ②④③① B. ④①②③ C. ④③②① D. ②③①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐是一类常见的物质,下列物质可直接反应生成盐的是( )
①金属 ②非金属 ③酸 ④碱 ⑤酸性氧化物 ⑥碱性氧化物.
A.只有③④
B.只有①②
C.只有①③⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=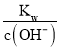 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A.原电池放电时,电子由负极经电解质溶液流向正极
B.原电池是将电能转变为化学能的装置
C.在原电池中,电流流入的一极是负极,该电极发生氧化反应
D.构成原电池的正极和负极必须是两种不同的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)己知 Na2CO3 溶液中存在水解平衡:CO32﹣+H2O![]() HCO3﹣+OH﹣,请用 Na2CO3 溶液及必要的试剂仪器,设计简单实验,证明盐类的水解是一个吸热过程.操作是_________,现象是___________。
HCO3﹣+OH﹣,请用 Na2CO3 溶液及必要的试剂仪器,设计简单实验,证明盐类的水解是一个吸热过程.操作是_________,现象是___________。
(2)已知等浓度的醋酸和醋酸钠溶液等体积混合呈酸性是因为醋酸的电离常数______醋酸钠的水解常数(选填“大于”、“小于”或“等于”);可知该温度下醋酸钠(或醋酸根)的水解常数_____1.0×10-7 (选填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) ![]() 3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
(1)此时A的浓度c(A)=_________mol/L,
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________ mol。
(3)B的平均反应速率:v(B)=__________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
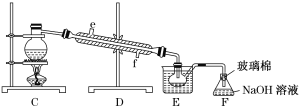
【题目】以下为工业从海水中提取液溴的流程图:
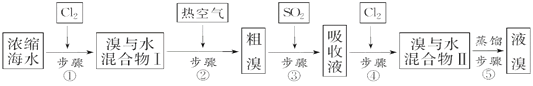
已知:溴的沸点为59 ℃,微溶于水,有毒性。请回答:
(1)某同学利用下图1装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞_______,打开活塞____________。
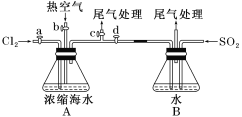
(2)步骤②中可根据____________________________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___________________________。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___________________________。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意_____,装置C中直接加热不合理,应改为______,图中E、F的作用是____________________、______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com