
【题目】在稀溶液中,强酸、强碱发生中和反应生成 1 mol 液态水时,放出热量 为 57.3 kJ。下列热化学方程式中正确的是( )
A.HNO3(aq)+KOH(aq)=H2O(l)+KNO3(aq) ΔH>-57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)=H2O(l)+NH4NO3(aq) ΔH<-57.3 kJ/mol
C.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)=H2O(l)+
H2SO4(aq)=H2O(l)+![]() BaSO4(s) ΔH>-57.3 kJ/mol
BaSO4(s) ΔH>-57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)=H2O(l)+CH3COONH4(aq) ΔH>-57.3 kJ/mol
【答案】D
【解析】
A. 硝酸是强酸,KOH是强碱,所以HNO3(aq)+KOH(aq)= H2O(l)+KNO3(aq)的反应热是ΔH=-57.3 kJ/mol,故A错误;
B. 硝酸是强酸,NH3·H2O 是弱碱,二者会发生反应:HNO3(aq)+NH3·H2O(aq)= H2O(l)+NH4NO3(aq),反应放出的热量小于57.3 kJ,所以ΔH>-57.3 kJ/mol,故B错误;
C. 硫酸和氢氧化钡除中和外还生成硫酸钡沉淀,生成沉淀也会放热,所以放出的热量高于中和热,则Ba(OH)2和H2SO4反应生成1 mol 液态水放出的热量大于57.3kJ,ΔH<-57.3 kJ/mol,故C错误;
D. 醋酸是弱酸,NH3·H2O 是弱碱,二者发生反应CH3COOH(aq)+NH3·H2O(aq)= H2O(l)+CH3COONH4(aq) ,反应放出热量小于57.3 kJ/,所以ΔH>-57.3 kJ/mol,故D正确;
正确答案是D。


科目:高中化学 来源: 题型:
【题目】下列实验方法或操作正确的是( )
A.用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂
B.配制![]() 溶液时,将
溶液时,将![]() 固体溶解在硫酸中,然后再加水稀释到所需的浓度
固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH
D.将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
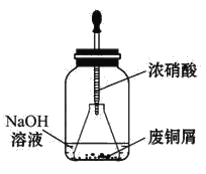
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式_________________________________。
(2)上图装置中NaOH溶液的作用是____________________________________。
(3)步骤二中,水浴加热所需仪器有____________、____________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
![]() 已知:①
已知:①![]()
②![]()
③![]() .
.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ______ .
![]() 生产甲醇的原料CO和
生产甲醇的原料CO和![]() 可由反应
可由反应![]() 得到.
得到.
①一定条件下![]() 的平衡转化率与温度、压强的关系如图
的平衡转化率与温度、压强的关系如图![]() 则
则![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 、B、C三点处对应平衡常数
、B、C三点处对应平衡常数![]() 、
、![]() 、
、![]() 的大小顺序为 ______ .
的大小顺序为 ______ .
②![]() 时,将
时,将![]() 和
和![]() 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______ ![]() 填序号
填序号![]() .
.
![]() .容器的压强恒定
.容器的压强恒定
![]() .容器内气体密度恒定
.容器内气体密度恒定
![]() 正
正![]() 逆
逆![]()
![]() 单位时间内消耗
单位时间内消耗![]() 同时生成
同时生成![]()
![]() 甲醇燃料电池
甲醇燃料电池![]() 简称
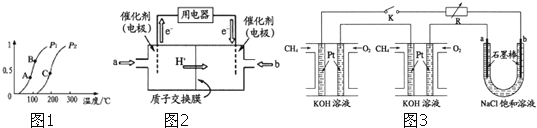
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,其电极反应式为 ______ .
,其电极反应式为 ______ .
![]() 某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为![]() 闭合K后,若每个电池甲烷用量均为
闭合K后,若每个电池甲烷用量均为![]() 标况
标况![]() ,且反应完全,则理论上通过电解池的电量为 ______
,且反应完全,则理论上通过电解池的电量为 ______ ![]() 列式计算.法拉第常数
列式计算.法拉第常数![]() ,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
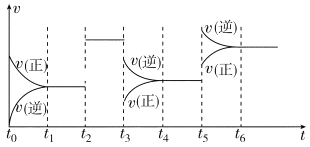
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内X转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )

A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com