在一容积为4L的密闭容器中,加入0.4mol的N
2和1.2mol的H
2,在一定条件下发生如下反应:N
2 (g)+3H
2 (g)═2NH
3 (g);△H<0,反应中NH
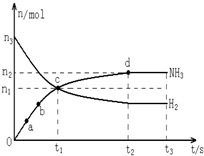
3的物质的量浓度变化情况如图1:

(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH
3)为
0.025
0.025
mol/(L?min).
(2)该反应的化学平衡常数表达式K
,随温度升高,K值将
减小
减小
(填“增大”、“减小”“不变”).
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH
3的物质的量浓度不可能为
ac
ac
.
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
C、D、E
C、D、E
(填序号).
A.3v(H
2)
(正)=2v(NH
3)
(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N
2的同时,减少了n mol NH
3(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数
不变
不变
(填“增大”、“减小”或“不变”).
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH
3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH
3浓度的变化曲线.
(7)已知化学反应N
2+3H
2=2NH
3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH
3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).
②
N
2(g)+
H
2(g)=NH
3(g);△H=
(a-b)kJ/mol
(a-b)kJ/mol
;
③N
2(g)和H
2生成NH
3(l)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.


 ;
; ;
;

 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:

 2EB2(g)+O2(g)
2EB2(g)+O2(g)  2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。