
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
则0.1 mol/L的下列溶液中,c(H+)最大的是
A. HCNB. HFC. CH3COOHD. HNO2
 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中.如图所示仪器及药品试回答:
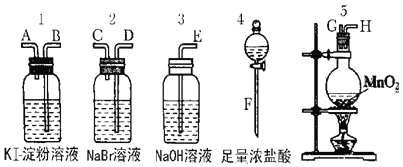
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接 ______ 、 ______ 接 ______ 、A接E.
(2)实验开始后装置5中反应的化学方程式为 ________________________ .
(3)装置3的作用是 ______ 反应的离子方程式为 ________________________ .
(4)装置1中产生的现象是 ______ 反应的离子方程式为 __________________ .
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为 ______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ![]()
B. ω![]()
C. ω![]()
D. c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中发生反应:4A(s)+3B(g)2C(g)+D(g),2min后B减小了1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(Lmin)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以醋酸为例探究弱酸的性质。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c =________ mol·L-1。
编号 | 酸的种类 | 酸的浓度/mol·L-1 | 酸的体积/mL | 镁条质量/g |
1 | 醋酸 | 1.0 | 10 | 2.0 |
2 | 盐酸 | c | 10 | 2.0 |
②实验步骤:a)检查装置(左图)的气密性后,添加药品;
b)反应开始后,___________________________(填写操作) ;
c)将所记录的数据转化为曲线图(右图)。

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:____________。
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比)。
设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①__________ | 量取25.00mL醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol·L-1 NaOH标准溶液装入______________中,滴定至终点,记录数据.重复滴定2次. |
②__________ | _______________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为bkJ/mol
C. 2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D. 当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高经济效益
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X :______________ 沉淀A:______________ 沉淀B:________________。
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-===2Fe2+。据此,回答下列问题:
(1)将反应3Cu+8H++2NO![]() ===3Cu2++2NO↑+4H2O拆写为两个“半反应式”,还原反应式:______________________________。
===3Cu2++2NO↑+4H2O拆写为两个“半反应式”,还原反应式:______________________________。
(2)此原理可用于电化学。锌锰碱性电池广泛应用于日常生活,电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com