
【题目】为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中.如图所示仪器及药品试回答:
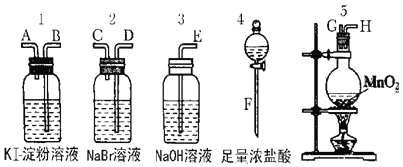
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接 ______ 、 ______ 接 ______ 、A接E.
(2)实验开始后装置5中反应的化学方程式为 ________________________ .
(3)装置3的作用是 ______ 反应的离子方程式为 ________________________ .
(4)装置1中产生的现象是 ______ 反应的离子方程式为 __________________ .
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为 ______________________________.
【答案】 D C B MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 吸收未反应完的Cl2,防止污染空气 Cl2+2OH-═Cl-+ClO-+H2O 溶液变蓝 Cl2+2I-═I2+2Cl- Cl2>Br2>I2
MnCl2+Cl2↑+2H2O 吸收未反应完的Cl2,防止污染空气 Cl2+2OH-═Cl-+ClO-+H2O 溶液变蓝 Cl2+2I-═I2+2Cl- Cl2>Br2>I2
【解析】(1)先制取氯气,然后将氯气通入NaBr溶液、再通入KI溶液检验氯气的强氧化性,氯气有毒不能排空,否则会污染大气,所以最后连接尾气处理装置,检验装置中导气管遵循“长进短出”原则,所以连接顺序是F接G、H接D、C接B、A接E,故答案为:D;C;B;
(2)实验开始后装置5中反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)二氧化硫有毒,不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以装置3的作用是吸收未反应完的Cl2,防止污染空气,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:吸收未反应完的Cl2,防止污染空气;Cl2+2OH-═Cl-+ClO-+H2O;
(4)氯气能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,所以看到的现象是溶液变蓝色,化学反应离子方程式为:Cl2+2I-═I2+2Cl-,故答案为:溶液变蓝;Cl2+2I-═I2+2Cl-;
(5)实验装置1,2的现象说明氯气和NaBr溶液、KI溶液发生反应,Cl2+2I-═I2+2Cl-,Cl2+2Br-=Br2+2Cl-,反应中Cl元素化合价由0价变为-1价、Br或I元素化合价由-1价变为0价,所以氯气作氧化剂、溴或碘单质作氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以Cl2的氧化性大于Br2>I2,已知溴离子的还原性弱于碘离子的还原性,说明Br2的氧化性大于I2,由此得出同主族元素随着原子序数的递增,元素非金属性逐渐减弱,单质氧化性逐渐减弱,Cl2>Br2>I2,故答案为:Cl2>Br2>I2。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。

请回答该实验中的问题。
(1)写出该反应的化学方程式_________________________________。
(2)实验前必须对整套装置进行的操作是__________________。
(3)干燥管中盛装的物质可以是_______,作用是_______________。
(4)试管中收集到的气体是______,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行_______,这一操作的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物
B.将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化
C.“雷雨发庄稼”的实质是自然固氮
D.自来水厂可用明矾对水进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
则0.1 mol/L的下列溶液中,c(H+)最大的是
A. HCNB. HFC. CH3COOHD. HNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com