
����Ŀ���ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ�����"Fe��ˮ������Ӧ��ʵ��"��

��ش��ʵ���е����⡣
��1��д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________��
��2��ʵ��ǰ���������װ�ý��еIJ�����__________________��
��3���������ʢװ�����ʿ�����_______��������_______________��
��4���Թ����ռ�����������______�����Ҫ��A�������ܿڴ���ȼ�����壬�����Ը��������_______����һ������Ŀ����_______________��
���𰸡� 3Fe��4H2O(g)![]() Fe3O4+4H2 ����װ�õ������� ��ʯ�ң����������������� ���ﷴӦ������H2 H2 �鴿 ��ֹ��ȼʱ���������п�������ը
Fe3O4+4H2 ����װ�õ������� ��ʯ�ң����������������� ���ﷴӦ������H2 H2 �鴿 ��ֹ��ȼʱ���������п�������ը
����������1������������ˮ������Ӧ�����������������������÷�Ӧ�Ļ�ѧ����ʽΪ3Fe��4H2O(g)![]() Fe3O4+4H2����2��ʵ��ǰ���������װ�ý��еIJ����Ǽ���װ�õ�����������3���������Ӧ��ʢװ�������ʣ���������������������ʿ����Ǽ�ʯ������4���������Ϸ�����֪�Թ����ռ����������������������ǿ�ȼ�����壬���Ҫ��A�������ܿڴ���ȼ�����壬�����Ը���������鴿����һ������Ŀ���Ƿ�ֹ��ȼʱ���������п�������ը��
Fe3O4+4H2����2��ʵ��ǰ���������װ�ý��еIJ����Ǽ���װ�õ�����������3���������Ӧ��ʢװ�������ʣ���������������������ʿ����Ǽ�ʯ������4���������Ϸ�����֪�Թ����ռ����������������������ǿ�ȼ�����壬���Ҫ��A�������ܿڴ���ȼ�����壬�����Ը���������鴿����һ������Ŀ���Ƿ�ֹ��ȼʱ���������п�������ը��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ������������ķ�Ӧ���Ƽ�������������ʵ�����Ϊ0.1mol,ˮ������Ϊ100g������˵����ȷ����

A. �ס��ҡ���������������ԭ��Ӧ
B. �׳�ַ�Ӧ�������������ԼΪ1.12L
C. ����ַ�Ӧ���ܲ���0.05molO2,ת�Ƶ���0.1mol
D. ����Ӧ�е���������Na2O2,��ԭ����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڸ��ϲ��ϵ��ǣ� ��
A.����˿B.������C.�ֻ�����D.������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ�������������������Ʊ����������ٵ����������������Ӧ��������Ӧ����2A12(SO4)3+3S![]() 2Al2O3+9SO2��
2Al2O3+9SO2��
��Ӧ��2Al2O3![]() 4Al+3O2��
4Al+3O2��
����˵����ȷ����
A. ��Ӧ����S ������������
B. ��Ӧ������Ԫ�ر�����
C. ������5.4gAlʱ����Ӧ��������ת��1.2mole-
D. ��Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ2��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦX+Y= M+NΪ���ȷ�Ӧ������˵������ȷ����
A��X������һ������M�ģ�Y������һ������N��
B����Ϊ�÷�ӦΪ���ȷ�Ӧ����һ��Ҫ���ȷ�Ӧ���ܽ���
C���ƻ���Ӧ���еĻ�ѧ�������յ�����С���γ��������л�ѧ�����ų�������
D��X��Y��������һ������M��N��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˱Ƚ�±�ص��ʵ�������ǿ������ʵ��������ȡCl2������MnO2��Ũ���ᷴӦ����ȡCl2������Cl2����ͨ��NaBr��Һ��KI������Һ�У���ͼ��ʾ������ҩƷ�Իش�
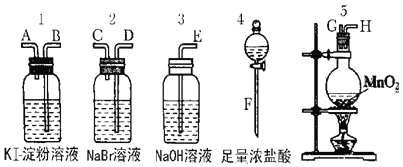
��1��������ȡ���������������ʱ���������ӿڵ�����˳��ΪF��G��H�� ______ �� ______ �� ______ ��A��E��
��2��ʵ�鿪ʼ��װ��5�з�Ӧ�Ļ�ѧ����ʽΪ ________________________ ��
��3��װ��3�������� ______ ��Ӧ�����ӷ���ʽΪ ________________________ ��
��4��װ��1�в����������� ______ ��Ӧ�����ӷ���ʽΪ __________________ ��
��5���������ӵĻ�ԭ�����ڵ����ӵĻ�ԭ�ԣ�ͨ��ʵ�飬±�ص��ʵ���������ǿ������˳��Ϊ ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���ƣ�����˵����ȷ����
A. ����480mL0.1mol/LCuSO4��Һ����ҪCuSO4��5H2O����12.0g
B. ��Ũ��������ϡ����ʱ����Ũ����ϡ�ͺ�����ת������ƿ��
C. ����5.3g̼���ƹ���ʱ���������ʺ�����ŷ�������ʹ�������ƫС
D. ���ݺ���Һ����ڿ��ߣ����ý�ͷ�ιܽ������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ʳ�����ij��ʯ[Ca3��PO4��2]��ȡ��[Ca��H2PO4��2]���ۺ����ø���������ˮ��Ĺ���������ͼ��

��1������ʯ�Ƴ��ʵ�Ŀ���� ______ ���йصĻ�ѧ����ʽΪ ______ ��
��2���ڸù��������и���ú�۲���Ҫ���������� ______ ��
��3��ˮ������ ______ ���ϣ����A�����ߡ�B����A���������ǽ�������B����ͳ���ǽ������ϣ�
��4����ҵ������������У�SO2�ڽӴ����б�������ΪSO3����֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2molSO2��1molO2�������Ϊ2L���ܱ������г�ַ�Ӧ���ų�����98.3kJ����ʱ���SO2�����ʵ���Ϊ1mol������Ȼ�ѧ����ʽΪ _______________________ ��ƽ�ⳣ��KΪ ______��
��5����ҵ���ýӴ��������ᣬ���IJ�Ʒ��98%����������Ϊ2H2SO4SO3�ķ������ᣨH2SO4��H2SO4SO3�Ļ�������SO3����������ԼΪ29%������98%��Ũ����ɱ�ʾΪSO3aH2O����SO329%�ķ�������ɱ�ʾΪbSO3H2O����a= ______ ��b= ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���Դ���Ϊ��̽����������ʡ�
��1��ʵ��һ��̽�����ǿ��������þ����Ӧ���ʵ�Ӱ�졣
�����ʵ�鷽�����±�������c =________ mol��L-1��
��� | ������� | ���Ũ��/mol��L-1 | ������/mL | þ������/g |
1 | ���� | 1.0 | 10 | 2.0 |
2 | ���� | c | 10 | 2.0 |
��ʵ�鲽�裺a�����װ�ã���ͼ���������Ժ�����ҩƷ��
b����Ӧ��ʼ��___________________________(��д������ ��
c��������¼������ת��Ϊ����ͼ����ͼ����

��д��0��5min���ᡢ������þ����Ӧ�ķ�Ӧ���ʱ仯���ɣ�____________��
��2��ʵ���������һƿ������Һ�������²ⶨ���д���ĵ���̶ȣ��ѵ���ĵ���ʷ�����ռԭ���ܷ������İٷֱȣ���
���ʵ�鷽�����������������Ͷ�Ӧ�IJⶨ������д���±��С�
���������� | �ⶨ���� |
��__________ | ��ȡ25.00mL������Һ����ƿ�У��μ�ָʾ������0.1000 mol��L-1 NaOH����Һװ��______________�У��ζ����յ㣬��¼���ݣ��ظ��ζ�2�Σ� |
��__________ | _______________________________________ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com