
【题目】(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
![]()
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
【答案】(1)1(1分),4:3(2分);(2)3:1(2分);
(3)2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+(2分);
(4)阳极(2分),2H++2HSO3-+2e-=S2O42-+2H2O(2分);
(5)NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
.设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
【解析】试题分析:(1)①在反应NO +O3=NO2+O2中,每产生1mol 的氧气,转移电子的物质的量是2mol,现在生成标准状况下11.2 L O2时,n(O2)=0.5mol,所以转移电子的物质的量是1mol。②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,反应方程式是:6NO2+4 CO(NH2)2=7N2+4CO2+8H2O,在该反应中,NO2是氧化剂,变为还原产物N2;CO(NH2)2是还原剂,变为氧化产物N2,所以氧化产物与还原产物的质量比为8:6=4:3。(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则根据电子守恒及原子守恒,可得方程式:3CO+2 NOx →N2+3CO2,化学方程式中CO2和N2的化学计量数比,3:1;(3)在酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,根据电子守恒、电荷守恒、原子守恒可得生成等物质的量的NO3-和NO2-时的离子方程式是2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;(4)用质子交换膜电解槽电解Ce3+使得Ce4+再生,再生时Ce3+失去电子,被氧化,所以生成的Ce4+在电解槽的阳极,同时在另一极发生还原反应生成S2O42一,反应的电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O;(5)在进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒
.设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒![]() = V÷22.4×2×(2-0)。解得V=243a.
= V÷22.4×2×(2-0)。解得V=243a.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述与图像对应符合的是
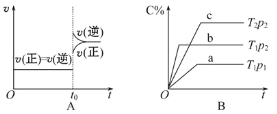

A.对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
B.p2>p1,T1>T2
C.该图像表示的化学方程式为:2A=B+3C
D.对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的血液呈________(填“酸性”、“弱酸性”、“中性”、“碱性”或“弱碱性”),我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈________性(填“偏酸”、“中性”或“偏碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子能在指定溶液中大量共存的是
A. 银氨溶液中:Na+、H+、NO3- B. 碘化钾溶液中:H+、H2O2、SO32-
C. 氢氧化钙溶液中:Na+、ClO-、HCO3- D. 偏铝酸钠溶液中:K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将16.1g某元素的含结晶水的硫酸盐晶体,加热后失去全部结晶水变为7.1g,该无水硫酸盐的式量为142,则该晶体(AxH2O)中的x值为( )
A.10 B.9 C.8 D.11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。

(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.在18 g 16O2中含有NA个氧原子
B.16O与18O核外电子排布方式相同
C.在标准状况下,1.12 L 16O2和1.12 L 18O2均含有0.1NA个氧原子
D.18O2和16O2化学性质几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修:有机化学基础】
聚芳脂(PAP)是分子主链上带有苯环和脂基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(CH2COCH2CH2COOH)合成聚芳脂E的路线:

已知:I. ![]()
II. ![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团名称为_____________。
(2)B的分子式为_________________,D的结构简式为___________。
(3)反应②的化学反应方程式为______________,反应类型为_______________。
(4)反应⑤的化学反应方程式为______________,反应类型为_______________。
(5)符合下列条件的C的同分异构体有________种。
a.能发生银镜反应 b.能与NaHCO3溶液反应
c.分子中有苯环,无![]() 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4组峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com