

 .
. .
. .
. .
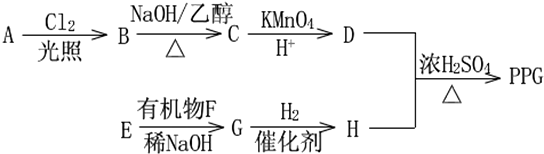
.分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为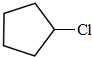 ,B发生消去反应生成C为
,B发生消去反应生成C为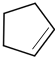 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(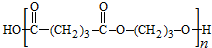 ),据此分析解答.
),据此分析解答.
解答 解:烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(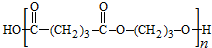 ),
),
(1)通过以上分析知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由B生成C的化学方程式为: ,
,
故答案为: ;
;
(3)由E和F生成G的反应类型为加成反应,G为HOCH2CH2CHO,G的化学名称为3-羟基丙醛,故答案为:加成反应;3-羟基丙醛;
(4)①由D和H生成PPG的化学方程式为: ,
,
故答案为: ;
;
(5)D为HOOC(CH2)3COOH,它的同分异构体中能同时满足:①能与饱和NaHCO3溶液反应产生气体,说明含-COOH,②既能发生银镜反应,又能发生水解反应,含有醛基、羧基,含其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 ,故答案为:
,故答案为: ;
;
(6)D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,故答案为:c.
点评 本题考查有机物的推断,为高频考点,为2015年高考真题,把握合成中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应中有Ag生成 | |
| B. | OH-通过隔膜从正极区移向负极区 | |
| C. | 消耗5.4g Al时,电路中转移0.6mol e- | |
| D. | 电池总反应为:2Al+3AgO=Al2O3+3Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(KJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com