
分析 (1)两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成;
(2)由方程式 2CO(g)+O2(g)?2CO2(g),计算平衡时反应消耗的n(O2),进而计算反应2H2O(g)?2H2(g)+O2(g)中生成O2、消耗的水的物质的量,所以n(H2O)平=n(H2O)起始-n(H2O)消耗.
解答 解:(1)由两个方程式可知,两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成,当知道H2O和H2或CO和CO2的平衡浓度时,由于两个方程式无法通过O2建立反应量的关系,所以无法求其混合气体的平衡组成,因而不能是这两组,故答案为:H2O,H2;CO,CO2;
(2)因n(CO2)平=bmol,由方程式 2CO(g)+O2(g)?2CO2(g),可知平衡时反应消耗的O2为$\frac{b}{2}$mol,则反应2H2O(g)?2H2(g)+O2(g)中生成O2的物质的量为(a+$\frac{b}{2}$)mol,消耗的水为2×(a+$\frac{b}{2}$)mol=(2a+b)mol,所以n(H2O)平=2mol-(2a+b)mol=(2-2a-b)mol,
故答案为:(2-2a-b)mol.
点评 本题考查化学平衡的计算,题目难度中等,(1)为易错点,注意分析两个方程式的特点.


科目:高中化学 来源: 题型:解答题
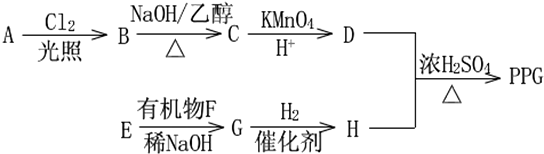

 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试纸变红色的溶液:K+、Fe2+、NO3-、Ca2+ | |
| B. | 加入铝粉产生氢气的溶液:SO42-、Cl-、K+、Mg2+ | |
| C. | 含有较多Al3+的溶液:SO42-、Na+、Mg2+、NO3- | |
| D. | 含有较多Fe2+的溶液:Na+、SO42-、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 2s时的压强是起始时的1.1倍 | |
| C. | 2s时物质A的转化率为30% | |
| D. | 2s时物质B的浓度为0.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com