
| A. | Cl-→Cl2 | B. | Fe3+→Fe2+ | C. | KClO3→KCl | D. | KI→I2 |
分析 不需要另外加入氧化剂或还原剂就能实现,说明该反应中氧化剂和还原剂是同一种物质,据此分析解答.
解答 解:A.该反应中Cl元素化合价由-1价变为0价,所以氯离子是还原剂,需要氧化剂才能实现,如二氧化锰等,故A错误;
B.铁元素化合价由+3价变为+2价,则铁离子作氧化剂,需要还原剂才能实现,如Cu等,故B错误;
C.该反应中Cl元素化合价由+5价变为-1价,氯酸钾是氧化剂,但该反应不需要还原剂就能实现,如加热氯酸钾制取氧气,该反应中氧化剂和还原剂都是氯酸钾,故C正确;
D.该反应中I元素化合价由-1价变为0价,则KI是还原剂,需要氧化剂才能实现,如氯气等,故D错误;
故选C.
点评 本题考查氧化还原反应,侧重考查基本概念,明确氧化剂、还原剂与元素化合价变化关系是解本题关键,易错选项是C.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
 如图从属关系中错误的是( )
如图从属关系中错误的是( )| 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 卤代烃 | 烃 | 有机物 |
| D | 离子化合物 | 电解质 | 化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
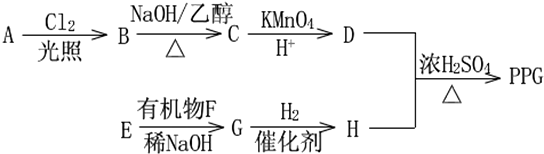

 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .E在元素周期表中的位置第三周期IA族.
.E在元素周期表中的位置第三周期IA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试纸变红色的溶液:K+、Fe2+、NO3-、Ca2+ | |
| B. | 加入铝粉产生氢气的溶液:SO42-、Cl-、K+、Mg2+ | |
| C. | 含有较多Al3+的溶液:SO42-、Na+、Mg2+、NO3- | |
| D. | 含有较多Fe2+的溶液:Na+、SO42-、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com