
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ����ͼ��ʾ�������õ����й��������£�
��Է������� | �ܶ�/��gcm��3�� | �е�/�� | �ܽ��� | |
���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森��Ӧ�ֲ��ﵹ��f�зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ��
�ش��������⣺
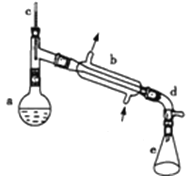
��1���ɻ�������ȡ����ϩ�ķ�Ӧ����Ϊ_________��
��2��װ��b������ˮ������______�����½��ϳ����Ͻ��³�����
��3���������Ƭ��������______���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������___������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��4����ʵ���������ײ����ĸ����������Ĺ���������Ϊ____��
��5���ڷ����ᴿ�У�ʹ�õ�������f������_____�������Ȼ��ƵIJ�����_____��
��6���ϳɹ����м���Ũ�����������_____��
���𰸡���ȥ��Ӧ �½��ϳ� ��ֹ���� B �Ѽ� ��Һ©�� ���� ��������ˮ��
��������
(1)���������ɻ���ϩ�����л�����ȥС�������ɷ����к���˫���IJ������л�������2������ˮ�½��ϳ��������������Ч������3�����Ƭ�Ĵ��ڿ��Է�ֹ�ڼ��ȹ����в��������������������Ƭʱ��Ҫ���Ѽ��ȵ���Һ��ȴ���ټ��룻(4)���ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է������Ӽ���ˮ��Ӧ���ɶ�����������5������ϩ������ˮ����Ӧ�ֲ��ﵹ��f�зֱ�������5%̼������Һ��ˮϴ�ӣ�����ϩ��ˮ�ֲ㣬�÷�Һ�������ᴿ���Ȼ����ǹ�������Һ�����ù��˷�����6����������Ũ�������������ˮ���ɻ���ϩ��
(1)���������ɻ���ϩ�����л�����ȥС�������ɷ����к���˫���IJ������л�����������ȥ��Ӧ����2������ˮ�½��ϳ��������������Ч��������װ��b������ˮ�������½��ϳ�����3�����Ƭ�Ĵ��ڿ��Է�ֹ�ڼ��ȹ����в��������������Լ������Ƭ�������Ƿ�ֹ���У��������Ƭʱ��Ҫ���Ѽ��ȵ���Һ��ȴ���ټ��룬��ѡB��(4)���ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է������Ӽ���ˮ��Ӧ���ɶ������ѣ����Ը����������Ĺ���������Ϊ�Ѽ�����5������ϩ������ˮ����Ӧ�ֲ��ﵹ��f�зֱ�������5%̼������Һ��ˮϴ�ӣ�����ϩ��ˮ�ֲ㣬�÷�Һ�������ᴿ������װ��f�Ƿ�Һ©�����Ȼ����ǹ�������Һ�����ù��˷�����6����������Ũ�������������ˮ���ɻ���ϩ��Ũ����������Ǵ�������ˮ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������½��з�Ӧ��mA������+nB ������![]() pC������+qD��������������ѹǿ���������¶ȣ����´ﵽƽ�⣬
pC������+qD��������������ѹǿ���������¶ȣ����´ﵽƽ�⣬![]() ��ʱ�仯���̾���ͼ��ʾ����Ը÷�Ӧ������ȷ����
��ʱ�仯���̾���ͼ��ʾ����Ը÷�Ӧ������ȷ����

A. ����Ӧ�Ƿ��ȷ�Ӧ�� m+n��p+q
B. �淴Ӧ�Ƿ��ȷ�Ӧ�� m+n��p+q
C. ����Ӧ�Ƿ��ȷ�Ӧ�� m+n��p+q
D. �淴Ӧ�Ƿ��ȷ�Ӧ�� m+n��p+q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����Ի�����������Ӱ�졣
(1)��֪���������е����仯��������·�Ӧ��
![]() ��H=+180 kJ��mol-1
��H=+180 kJ��mol-1
![]() ��H=+68 kJ��mol-1
��H=+68 kJ��mol-1
��![]() ��H=__________ kJ��mol-1
��H=__________ kJ��mol-1
(2)���ڷ�Ӧ![]() �ķ�Ӧ�������£�
�ķ�Ӧ�������£�
��һ����
�ڶ�����![]()
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⣬��һ����Ӧ�У�����=k1����c2(NO)������=k1����c(N2O2)��k1����k1��Ϊ���ʳ����������¶�Ӱ�졣����������ȷ����______(����)
A ������Ӧ�������ɵ�һ����Ӧ���ʾ���
B ͬһ�¶��£�ƽ��ʱ��һ����Ӧ��k1����k1��Խ��Ӧ����̶�Խ��
C �ڶ�����Ӧ���ʵͣ����ת����Ҳ��
D �ڶ�����Ӧ�Ļ�ܱȵ�һ����Ӧ�Ļ�ܸ�
(3)��ѧ���о�����һ�ָ�Ч���������Խ�CO��NO2����ת��Ϊ����Ⱦ���壬��Ӧ����ʽΪ��![]() ��H<0��ij�¶��£���10 L�ܱ������зֱ����0��1 mol NO2��0��2 mol CO������������Ӧ�����ŷ�Ӧ�Ľ��У������ڵ�ѹǿ�仯���±���ʾ��
��H<0��ij�¶��£���10 L�ܱ������зֱ����0��1 mol NO2��0��2 mol CO������������Ӧ�����ŷ�Ӧ�Ľ��У������ڵ�ѹǿ�仯���±���ʾ��
ʱ�䣯min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
ѹǿ��kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
�ڴ��¶��£���Ӧ��ƽ�ⳣ��Kp=___________kPa-1(K
(4)����������װ�е���Ԫ��װ�ã���������CO��NO�ȵ���Ⱦ����Ӧ��������
I�� NO+Pt(s)=NO(*) [Pt(s)��ʾ������NO(*)��ʾ����̬NO����ͬ]
��CO+Pt(s)=CO(*)
III��NO(*)=N(*)+O(*)
IV��CO(*)+O(*)=CO2+2Pt(s)
V��N(*)+N(*)=N2+2 Pt(s)
VI��NO(*)+N(*)=N2O+2 Pt(s)
β���з�Ӧ�P������Ũ�����¶ȵı仯��ϵ��ͼ��

��330�����µĵ�������������Ҫ��Ӧ�Ļ�ѧ����ʽ��__________________________��
�ڷ�ӦV�Ļ��_____��ӦVI�Ļ��(�<������>����=��)��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����ָ������������½���ѧ��ת��Ϊ���ܵ�װ�á�ij����ȼ�ϵ�صĹ���ԭ����ͼ��ʾ������˵����ȷ����

A. ���Ӵ�b�����������·����a
B. HS-����������������ת��ΪSO42-�ķ�Ӧ��HS-+4H2O-8e-=SO42-+9H+
C. �������Ӧ��ֱ��ȼ�գ������������ʲ���仯
D. ���õ�ص�·����0.4mol���ӷ���ת�ƣ�����0.5molH+ͨ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����з�Ӧ����ʽ����ע����Ӧ������������Ҫ�����
��1��ʵ�����Ʊ���ϩ_______________����Ӧ������___________��
��2���������Ҵ��ķ�Ӧ______________����Ӧ������������Ԫ�ص���Դ��________��
��3������������������ˮ��Һ����_____________���˷�Ӧ��±����������ת��Ϊ______�����ʣ�
��4������Ũ���ᡢŨ����Ļ�����ڼ���ʱ������Ӧ__________����Ӧ������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��B��C��D��E֮�䷢�����µ�ת����
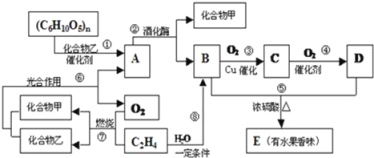
��1��д��D�����й����ŵ����ƣ�_____��C���ʵĽṹ��ʽ��____��
��2����A��ˮ��Һ�м������Ƶ�Cu��OH��2������ʱ������ʵ��������__________��
��3����д������ת���Ļ�ѧ��Ӧ����ʽ��
�٣�C6H10O5��n��A��_____�� ����ϩ���ɾ���ϩ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ��������������Ķ���������Ԫ�أ���ԭ�Ӱ뾶�������������Ĺ�ϵ����ͼ1��Eԭ��������ϵĵ�������Dԭ��������������4����D���Ӻ�������Ų���C2����ͬ��

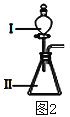
�Իش�
��1��Ԫ��E��Ԫ�����ڱ��е�λ����___________________��
��2����Ԫ��D��������������������������ͬ������________________�����û�ѧʽ������ͬ��
��3��B��E����������Ӧ��ˮ������Խ�����_________________��������ͼ2��װ����֤�������������ǿ��������װ���м�����Լ��ֱ�Ϊ����___________����__________���۲쵽��ʵ��������________________________��
��4������������Ԫ����ɵ����ʣ�����ɺͽṹ��Ϣ���±���
���� | ��ɺͽṹ��Ϣ |
a | ����A��C��D���� |
b | C��D��ɵĻ������ԭ����֮��Ϊ1��1 |
c | ��ѧ���ΪAC2 |
��a���еĻ�ѧ����___________________________________��
��b��c��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�ϵͳ���з�ӦC(s)��CO2(g) ![]() 2CO(g)����ʹ��Ӧ�����ӿ��Ĵ�ʩ��
2CO(g)����ʹ��Ӧ�����ӿ��Ĵ�ʩ��
��ͨ����С�����������ѹǿ�� �������¶� �۽�̿���顡 ��ͨ��CO2�� ������̿���� ����������ͨ��N2ʹ��ѹǿ����
A. �٢ڢۢ�B. �٢ڢܢ�C. �٢ڢۢ�D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��þ(������FeCO3)Ϊԭ����ȡ����þ���壬���ⶨMg2+��������ԭ����ȫ����һ������ϡ�����У���������H2O2���ð�ˮ������Һ��pH�����ú���ˣ���ȥ����������Һ�ᾧ������þ���塣
��1��30.00mL 5.00 mol��L1��ϡ�����������ܽ�ԭ�ϵ�����Ϊ___________��
��2���Ӱ�ˮ����pH�ٽ�Fe3+ˮ�⣬Fe3+ˮ�����ӷ���ʽΪ___________��
��3����֪��Ksp[Fe(OH)3]��1.0��1039��Ksp[Mg(OH)2]��1.0��1012�������£�����Һ��c(Mg2��)��0.01mol��L1����ʹ��Һ�е�c(Fe3��)��1��106mol��L1���������ҺpH��ΧΪ___________��
��4�����������з����ⶨ�ᾧ����þ��Mg2+�ĺ�����
��֪������pHΪ9~10ʱ��Mg2+��Zn2+������EDTA(H2Y2)�γ������
����pHΪ5~6ʱ��Zn2+������EDTA��Ӧ�����ܽ�Mg2+��EDTA�γɵ�������е�Mg2+���û��������� Zn2+ +MgH2Y��ZnH2Y+Mg2+
����1��ȷ��ȡ�õ�������þ����1.50g���������EDTA�����100mL pH9~10֮����ҺA
����2��ȷ��ȡ25.00mL��ҺA����ƿ�У���0.10mol��L1Zn2+����Һ�ζ����ζ����յ㣬����Zn2+����Һ�����Ϊ20.00mL
����3��ȷ��ȡ25.00mL��ҺA����һֻ��ƿ�У�����pH��5~6����0.10mol��L1Zn2+����Һ�ζ����ζ����յ㣬����Zn2+����Һ�����Ϊ30.00mL��
����ýᾧ����þ��Mg2+����������(������������)��___________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com