
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试 剂 | 编号及现象 | |
试 管 | 滴 管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
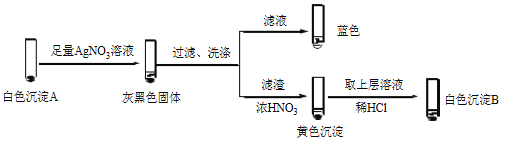
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
KI溶液 |
KI溶液 AgNO3溶液 a b |
KI溶液 CuSO4溶液 c d |
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-。其原因一是从K值______;二是从Cu2+的反应特点______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法正确的是( )

A. 途径 1 中产生的Cl2 可以回收循环利用,也可以通入饱和CaCl2 溶液中除去
B. 途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C. X 气体可以是N2,目的是做保护气,抑制 CuCl22H2O 加热过程可能的水解
D. CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家最近研制出利用太阳能产生激光,使海水分解。
①太阳光分解海水时,光能转化为_____能,水分解时,断裂的化学键是_____(填“离子键”或“共价键”)
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则2H2(g)+O2(g)=2H2O(l) H=_____kJ·mol-1
(2)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为2Fe+O2+2H2O=2Fe(OH)2,
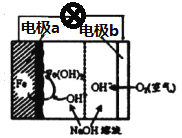
①Fe为原电池的______(填“正极”或“负极”),电极b上发生_____反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1的FeCl2溶液中:H+、Al3+、SO42—、ClO
B. 无色透明的溶液中:Al3+、Fe3+、NO3—、SCN—
C. 与Al反应能放H2的溶液中:Cu2+、NH4+、CO32-、Cl
D. c(OH)/c(H+)=1×1014的溶液中:K+、Na+、I、SiO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需用坩埚钳夹取加热后的蒸发皿
B. 容量瓶使用前无需检漏
C. 蒸馏实验结束后,先停止通冷凝水,再停止加热
D. 焰色实验所用的铂丝,每次用完后都要用稀硫酸洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com