
【题目】下列分散系能产生丁达尔效应的是
A. 稀硫酸 B. 蔗糖溶液 C. 氢氧化铁胶体 D. 硫酸铜溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 破坏化学键的过程,一定是化学变化过程
B. NaOH熔化时,既破坏了离子键又破坏了共价键
C. 反应H2+Cl2![]() 2HCl破坏了共价键,形成了共价键
2HCl破坏了共价键,形成了共价键
D. 17Cl和18Cl的相互转化属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在反应:A(g)+3B(g)![]() 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是
A. 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C. 图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用如图装置制取ICl3。
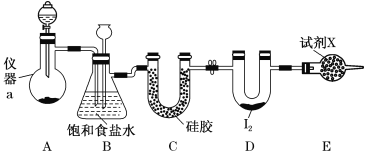
(1)仪器a的名称是________。
(2)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为__________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:____________________________________________。
(4)试剂X为________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为________________。
(6)500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水-乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO的体积分数为________。(保留三位有效数字)(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2===2NaI+Na2S4O6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于_______(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为_________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为___________,其所含化学键有__________,乙醇分子中C原子的杂化轨道类型为____________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(HSCN)、异硫氰酸(HNCS)两种。两者沸点:前者_____后者(填“高于”或“低于”)。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为________________。

(5)铜与金形成的金属互化物的晶胞结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为__________g·cm-3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等),某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量盐酸后过滤出的滤渣中含有____________________,加入过量的NaOH溶液,过滤后的滤液中含有的溶质有_______________________(均填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,则每消耗0.1mol氧气有多少_____mol Fe(OH)2被氧化。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为___________________,沉淀A加热得到Al2O3的化学方程式为____________________。
(4)假设铝土矿中含杂质49%,则1吨铝土矿理论上可生产多少__________mol铝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com