
【题目】下列说法正确的是
A. 破坏化学键的过程,一定是化学变化过程
B. NaOH熔化时,既破坏了离子键又破坏了共价键
C. 反应H2+Cl2![]() 2HCl破坏了共价键,形成了共价键
2HCl破坏了共价键,形成了共价键
D. 17Cl和18Cl的相互转化属于化学变化
【答案】C
【解析】
A.破坏化学键的过程,不一定是化学变化过程,如NaCl固体溶于水,破坏了离子键,是溶解过程,没发生化学变化,故A错误;
B. NaOH中钠离子和氢氧根离子之间是通过离子键结合,氢氧根离子中氧原子和氢原子之间是通过共价键结合,NaOH熔化电离出钠离子和氢氧根离子,破坏了离子键,没有破坏共价键,故B错误;
C. H2、Cl2、HCl三者均以共价键结合,则反应H2+Cl2![]() 2HCl破坏了共价键,形成了共价键,故C正确;
2HCl破坏了共价键,形成了共价键,故C正确;
D.化学变化时分子变为原子,原子又重新组合成新的分子,在变化的过程原子本身不发生变化。而17Cl和18Cl的相互转化过程中改变了原子核中的中子数,原子本身发生了变化,是核变化,不属于化学变化,也不属于物理变化,故D错误。答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某课题组对某样品W(组成用CxHyOzNaSb表示)进行探究。
实验一:确定W中元素组成
(1)取W样品,将有机氮转化成NH4+,_____________(补充实验方案),证明W中含氮元素。
(2)用燃烧法确定W样品中含碳、氢、硫三种元素,装置如图所示。
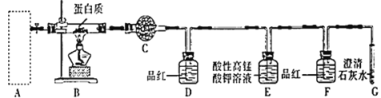
①A框内是加热固体制备氧气发生装置,写出A中反应的化学方程式:__________________。
②写出E中发生反应的离子方程式:_________________。
③从实验简约性考虑,D、E、F、G装置可以用下列装置替代:

能证明W含碳元素的实验现象是__________________。
实验二:测定W中硫元素含量
(3)取wgW样品在过量的氧气中充分燃烧,用V1mLc1mol·L-1碘水溶液吸收SO2,用V2mLc2mol·L-1Na2S2O3溶液滴定过量的I2。已知:2Na2S2O3+I2=2NaI+Na2S4O6。滴定终点的标志是__________________。该W样品中硫元素的质量分数为_________%。
(4)二氧化硫通入吸收液前必须通过过量的赤热铜粉(SO2不参与反应),否则会导致测定的硫元素质量分数_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3H2ONH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是( )
①适当升高温度②加入NH4Cl固体③通入NH3④加入少量盐酸
A.①②B.②③C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】




图A 图B 图C 图D
A. 除去CO中的CO2
B. 苯萃取碘水中的I2分出水层后的操作
C. 配制0.10 mol·L-1NaOH溶液
D. 记录滴定终点读数为12.20mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是( )
A. 用FeCl3溶液可以鉴别化合物X和Y
B. Y的苯环上的二氯取代物有8种同分异构体
C. 在浓硫酸、加热的条件下,化合物X发生消去反应
D. X转化为Y的反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有15种
B. 已知![]() 为加成反应,由此可知X为氯乙烯
为加成反应,由此可知X为氯乙烯
C. 分子式为C4H8ClBr的有机物共有9种
D.  互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试 剂 | 编号及现象 | |
试 管 | 滴 管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
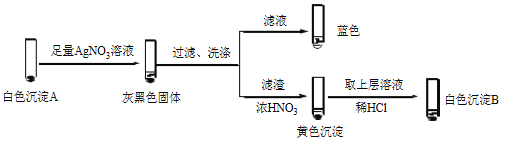
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
KI溶液 |
KI溶液 AgNO3溶液 a b |
KI溶液 CuSO4溶液 c d |
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-。其原因一是从K值______;二是从Cu2+的反应特点______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com