
【题目】




图A 图B 图C 图D
A. 除去CO中的CO2
B. 苯萃取碘水中的I2分出水层后的操作
C. 配制0.10 mol·L-1NaOH溶液
D. 记录滴定终点读数为12.20mL
科目:高中化学 来源: 题型:
【题目】下列物质的制备能够成功的是
A. 电解饱和食盐水制备金属钠 B. MnO2和稀盐酸反应制备氯气
C. 铁和盐酸反应制备氯化铁 D. 石灰乳和氯气制备漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
平衡时c(NH3) | c1 | c2 |
平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
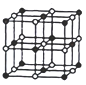
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 破坏化学键的过程,一定是化学变化过程
B. NaOH熔化时,既破坏了离子键又破坏了共价键
C. 反应H2+Cl2![]() 2HCl破坏了共价键,形成了共价键
2HCl破坏了共价键,形成了共价键
D. 17Cl和18Cl的相互转化属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)⑦的离子结构示意图是__________;
(2)表中最活泼的金属是________(填写元素符号),能形成的最稳定气态氢化物的化学式是_______;
(3)
(4)⑤、⑧形成化合物中含有的化学键是________(填“离子键”或“共价键”);
(5)1mol④的单质与足量②的氢化物完全反应产生的气体在标准状况下的体积为_____;
(6)写出⑥的单质与④的最高价氧化物的水化物溶液反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用如图装置制取ICl3。
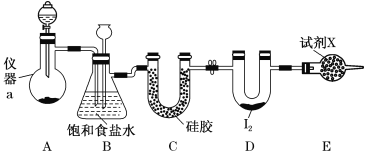
(1)仪器a的名称是________。
(2)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为__________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:____________________________________________。
(4)试剂X为________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为________________。
(6)500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水-乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO的体积分数为________。(保留三位有效数字)(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2===2NaI+Na2S4O6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com