
【题目】下列物质的制备能够成功的是
A. 电解饱和食盐水制备金属钠 B. MnO2和稀盐酸反应制备氯气
C. 铁和盐酸反应制备氯化铁 D. 石灰乳和氯气制备漂白粉
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_______(填具体元素符号或化学式,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的子式是_________,第三周期中碱性最强的化合物的化学式是____________________。
(3)最高价氧化物是两性氧化物的元素是____________;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式_______________________________________。
(4)用电子式表示元素④与⑥形成化合物的形成过程:________________________,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)表示③与①最高价态形成的化合物电子式___________________,该化合物分子由___________(填“极性”“非极性”)键形成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是
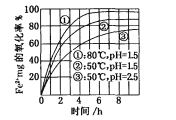
A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是
A. 乙酸溶液的pH小于7
B. 乙烯可与溴发生加成反应
C. 苯能使酸性KMnO4 溶液褪色
D. 乙醇在一定条件下能被氧化成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂在山坡坑道的仓库里贮有氯气钢瓶。某天,有一只贮有氯气的钢瓶损坏,造成氯气泄漏。
(1)处理钢瓶的方法正确的是________。
A.钢瓶推到坡下的小河里
B.把钢瓶丢到深坑里,用石灰填埋
C.把钢瓶扔到农田中
(2)钢瓶处理后,工人应立即________。
A.转移到坡下 B.转移到坡上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组对某样品W(组成用CxHyOzNaSb表示)进行探究。
实验一:确定W中元素组成
(1)取W样品,将有机氮转化成NH4+,_____________(补充实验方案),证明W中含氮元素。
(2)用燃烧法确定W样品中含碳、氢、硫三种元素,装置如图所示。
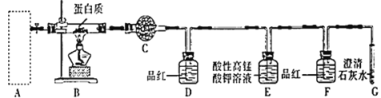
①A框内是加热固体制备氧气发生装置,写出A中反应的化学方程式:__________________。
②写出E中发生反应的离子方程式:_________________。
③从实验简约性考虑,D、E、F、G装置可以用下列装置替代:

能证明W含碳元素的实验现象是__________________。
实验二:测定W中硫元素含量
(3)取wgW样品在过量的氧气中充分燃烧,用V1mLc1mol·L-1碘水溶液吸收SO2,用V2mLc2mol·L-1Na2S2O3溶液滴定过量的I2。已知:2Na2S2O3+I2=2NaI+Na2S4O6。滴定终点的标志是__________________。该W样品中硫元素的质量分数为_________%。
(4)二氧化硫通入吸收液前必须通过过量的赤热铜粉(SO2不参与反应),否则会导致测定的硫元素质量分数_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积________mL ,应选用容量瓶的规格_________mL。 除容量瓶外还需要的其它仪器_______________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________________,溶液注入容量瓶前需恢复到室温,这是因为___________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________;
b.加蒸馏水时不慎超过了刻度______________;
c.定容时俯视________________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度? _______________________
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】




图A 图B 图C 图D
A. 除去CO中的CO2
B. 苯萃取碘水中的I2分出水层后的操作
C. 配制0.10 mol·L-1NaOH溶液
D. 记录滴定终点读数为12.20mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com