
【题目】实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积________mL ,应选用容量瓶的规格_________mL。 除容量瓶外还需要的其它仪器_______________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________________,溶液注入容量瓶前需恢复到室温,这是因为___________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________;
b.加蒸馏水时不慎超过了刻度______________;
c.定容时俯视________________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度? _______________________
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _______
【答案】2.1 250量筒、烧杯、玻璃棒、胶头滴管BCAFED避免配制成的溶液浓度偏小容量瓶只能盛放室温下的溶液偏低 偏低偏高重做实验重做实验
【解析】
(1)根据稀释前后HCl物质的量不变列式计算。配制250mL溶液应选用250mL容量瓶。由浓溶液配制一定体积物质的量浓度的溶液还需要的仪器是:量筒、烧杯、玻璃棒、胶头滴管。
(2)由浓溶液配制一定体积物质的量浓度的溶液的实验步骤:计算→量取→稀释→冷却→转移→洗涤→定容→摇匀。
(3)将洗涤液都转移入容量瓶的目的是:确保溶质全部转移到容量瓶中,避免所配溶液物质的量浓度偏低。溶液注入容量瓶前需恢复至室温的目的是:容量瓶是定量容器,只能盛放室温下的溶液。
(4)根据公式cB=![]() 分析。
分析。
(5)加蒸馏水超过刻度线、转移溶液时有溶液掉在容量瓶外都要重新配制溶液。
(1)根据稀释前后HCl物质的量不变列式计算,1.18g/mLV(浓盐酸)×36.5%÷36.5g/mol=0.1mol/L×0.25L,解得V(浓盐酸)=2.1mL。配制250mL溶液应选用250mL容量瓶,选用容量瓶的规格为250mL。由浓溶液配制一定体积物质的量浓度的溶液还需要的仪器是:量筒、烧杯、玻璃棒、胶头滴管。
(2)由浓溶液配制一定体积物质的量浓度的溶液的实验步骤:计算→量取→稀释→冷却→转移→洗涤→定容→摇匀,配制时正确的操作步骤是:BCAFED。
(3)操作A中,将洗涤液都转移入容量瓶的目的是:确保溶质全部转移到容量瓶中,避免所配溶液物质的量浓度偏低。由于浓溶液稀释过程中有热效应,而容量瓶是定量容器,温度会影响容量瓶的容积,溶液注入容量瓶前需恢复至室温的目的是:容量瓶是定量容器,只能盛放室温下的溶液。
(4)根据公式cB=![]() 分析。
分析。
a.没有进行A操作,溶质物质的量偏小,所配溶液物质的量浓度偏低;
b.加蒸馏水时不慎超过了刻度,溶液体积偏大,所配溶液物质的量浓度偏低;
c.定容时俯视,溶液体积偏小,所配溶液物质的量浓度偏高。
(5)加蒸馏水时不慎超过了刻度,溶液体积偏大,实验失败,重新配制。向容量瓶中转移溶液时不慎有液滴掉在容量瓶外,溶质物质的量偏小,实验失败,重新配制。


科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存的是
A.Fe3+、I-、Cl-、Na+B.Cl-、K+、AlO2-、OH-
C.H+、Na+、K+、CO32-D.Ba2+、Mg2+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗癌新药H的一种合成路线如下:
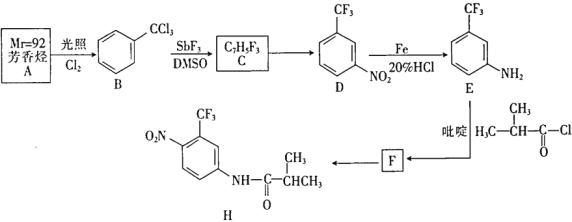
回答下列问题:
(1)A的名称是____________。
(2)B→C的反应类型是__________________。
(3)吡啶的结构简式为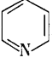 具有碱性,在E→F中吡啶的作用是_________________。
具有碱性,在E→F中吡啶的作用是_________________。
(4)写出E→F的化学方程式_____________。
(5)T(C7H7NO2)是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有______种。
①-NH2直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体
其中,在核磁共振氢谱上有4个峰且峰的面积比为1:2:2:2的结构简式为_________________。
(6)以CH3CH2COCl和![]() 为原料,经三步合成某化工产品(
为原料,经三步合成某化工产品(![]() )路线为(无机试剂任选):___________________。
)路线为(无机试剂任选):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备能够成功的是
A. 电解饱和食盐水制备金属钠 B. MnO2和稀盐酸反应制备氯气
C. 铁和盐酸反应制备氯化铁 D. 石灰乳和氯气制备漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L乙烷中所含的极性共价键数目为NA
B. 500C、101KPa时3.2gSO2和足量的O2充分反应后生成SO3的数目为0.05NA
C. 100mL12mol/L的浓硝酸与过量铜反应,转移的电子数介于0.6NA~0.9NA之间
D. 1L0.1mol/LNH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X 均为中学常见的单质或化合物,它们之间有如下转化关系(副产物已略去)。 试回答:
![]()
(1)若 X 是气体单质,则 A 可能是_____.
a.C b.Al c.Na d.Fe
(2)若 X 是金属单质,向 C 的水溶液中滴加 AgNO3 溶液,产生不溶于稀 HNO3 的白色沉淀;X 在 A
中可以燃烧。
①B 的化学式为_____;C 溶液在贮存时应加入少量 X,理由是(用必要的文字和离子方程式 表示)_________。
②向 C 的溶液中加入氢氧化钠溶液,现象是_________;写出涉及到的氧化还原反应的 化学方程式_____。
(3)若 A、B、C 为含有同种金属元素的化合物,X 为强酸或强碱溶液,则 B 的化学式为_____; 反应②的离子方程式为__________________或________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行中和热的测定时,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.为了使反应均匀进行,可向酸(碱)中分次加入碱(酸)
C.测量溶液的温度计要一直插在溶液中
D.为了使反应更完全,可以使酸或碱适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com