
【题目】(1)科学家最近研制出利用太阳能产生激光,使海水分解。
①太阳光分解海水时,光能转化为_____能,水分解时,断裂的化学键是_____(填“离子键”或“共价键”)
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则2H2(g)+O2(g)=2H2O(l) H=_____kJ·mol-1
(2)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为2Fe+O2+2H2O=2Fe(OH)2,
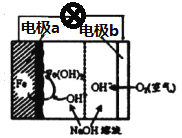
①Fe为原电池的______(填“正极”或“负极”),电极b上发生_____反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为_________。
【答案】化学 共价键 -571.6 负极 还原 0.8×6.02×1023
【解析】
(1)①利用太阳能分解海水是将太阳能转化为化学能,水分解时,断裂H-0键;
②注意H与热化学方程式化学计量数相对应,化学计量数代表的是物质的量,根据已知进行计算;
(2)①根据负极:升失氧;正极:降得还进行判断。
②铁的化合价从0升高到+2价,计算可得。
(1)①太阳光分解海水时,光能转化为化学能,水为共价化合物,存在O-H键,分解时,断裂的化学键是共价键;
答案:化学 共价键
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则
2mol氢气完全燃烧生成液态水放出的热量为2mol×2g/mol×142.9kJ/g=571.6kJ,则
2H2(g)+O2(g)=2H2O(l) H=-571.6kJ·mol-1;
答案:-571.6
(2)根据电极反应式2Fe+O2+2H2O=2Fe(OH)2和图像可知,铁化合价升高失电子发生氧化反应为负极,氧气化合价降低得电子发生还原反应为正极;
①Fe为原电池的负极,电极b上发生还原反应;②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子物质的量为22.4g×2/(56g/mol)=0.8mol,转移电子个数为0.8×6.02×1023;
答案:0.8×6.02×1023


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常温下, 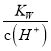 =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是(填0~1、1~2、2~3、3~4、4~5 )_____ min,原因是_____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为_________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列___________以减慢反应速率。(填写代号)
A.冰块 B.HNO3溶液 C.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质,A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是___________
②在该条件达到反应的限度(平衡状态)时反应物的转化率为____________
(转化率=(转化的物质的量/初始物质的量)×100%)(计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等),某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量盐酸后过滤出的滤渣中含有____________________,加入过量的NaOH溶液,过滤后的滤液中含有的溶质有_______________________(均填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,则每消耗0.1mol氧气有多少_____mol Fe(OH)2被氧化。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为___________________,沉淀A加热得到Al2O3的化学方程式为____________________。
(4)假设铝土矿中含杂质49%,则1吨铝土矿理论上可生产多少__________mol铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)用作媒染剂和有机合成上的氯化催化剂。实验室制备四氯化锡的装置如下图(部分夹持装置已略去)。已知:①金属锡熔融时通入干燥氯气反应可生成四氯化锡;②无水四氯化锡熔点-33℃,沸点114.1℃;③无水四氯化锡遇水蒸气生成白色烟雾。下列说法不正确的是

A. ①、②、⑥、⑦的试管中依次盛装MnO2、饱和食盐水、浓H2SO4、NaOH溶液
B. 实验时滴加浓盐酸反应一段时间,然后再点燃④处的酒精灯
C. ⑤装置用于收集SnCl4,浸泡在冷水浴中效果更好
D. ⑥、⑦两个试管可以用一个装有碱石灰的干燥管来代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com