
【题目】以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L1的稀硫酸至少能溶解原料的质量为___________。
(2)加氨水调节pH促进Fe3+水解,Fe3+水解离子方程式为___________。
(3)已知:Ksp[Fe(OH)3]=1.0×1039,Ksp[Mg(OH)2]=1.0×1012。室温下,若溶液中c(Mg2+)=0.01mol·L1,欲使溶液中的c(Fe3+)≤1×106mol·L1,需调节溶液pH范围为___________。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)。___________
【答案】12.60g Fe3+ +3H2O![]() Fe(OH)3+3H+ 3≤pH≤9 6.4%
Fe(OH)3+3H+ 3≤pH≤9 6.4%
【解析】
(1)![]() 、
、![]() 均能和稀硫酸反应而溶解,等物质的量的硫酸,溶解等物质的量的
均能和稀硫酸反应而溶解,等物质的量的硫酸,溶解等物质的量的![]() 、
、![]() ,但
,但![]() 摩尔质量大,所以
摩尔质量大,所以![]() 含量越低,能溶解原料的质量越少;
含量越低,能溶解原料的质量越少;
(2)Fe3+水解,生成Fe(OH)3和H+,依此书写离子方程式;
(3)依据题给条件,分别计算开始形成Mg(OH)2沉淀、Fe3+完全沉淀时的pH,即能确定使Fe3+完全沉淀,而Mg2+不沉淀的pH范围;
(4)依据题中所给信息及反应关系,求出1.5g晶体中,Mg2+的质量,然后计算其质量分数;
(1)已知原料主要成分是![]() ,含有少量
,含有少量![]() 杂质,用一定量的稀硫酸溶解时,
杂质,用一定量的稀硫酸溶解时,![]() 含量越低,能溶解原料的质量越少,当原料中不含
含量越低,能溶解原料的质量越少,当原料中不含![]() 杂质,硫酸溶解
杂质,硫酸溶解![]() ,n(H2SO4)=0.15mol,则溶解的
,n(H2SO4)=0.15mol,则溶解的![]() 的物质的量为
的物质的量为![]() ,其质量为:0.15mol
,其质量为:0.15mol![]() 84g/mol=12.6g,故至少能溶解原料
84g/mol=12.6g,故至少能溶解原料![]() ;
;
本题答案为:12.6g;
(2)Fe3+水解离子方程式为:Fe3+ +3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
本题答案为:Fe3+ +3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(3)根据![]() 可知
可知![]() 开始出现沉淀时溶液中
开始出现沉淀时溶液中![]() ,此时溶液中
,此时溶液中![]() ,根据
,根据![]() 可知,
可知,![]() 完全沉淀时溶液中
完全沉淀时溶液中![]() ,此时溶液中
,此时溶液中![]() ,所以需调节溶液
,所以需调节溶液![]() 范围为
范围为![]() ;
;
本题答案为:3![]() pH
pH![]() 9;
9;
(4)![]() 、
、![]() 与
与![]() 均按
均按![]() 反应,则由步骤2可得:
反应,则由步骤2可得:![]() 溶液A中过量的EDTA:
溶液A中过量的EDTA:![]() ,则
,则![]() 溶液A中剩余
溶液A中剩余![]() 的量:
的量:![]() ;由步骤3可得:
;由步骤3可得:![]() 溶液A中
溶液A中![]() 总量:
总量:![]() ,则
,则![]() 溶液A中
溶液A中![]() 总量:
总量:![]() ,所以
,所以![]() 中
中![]() ,该结晶硫酸镁中
,该结晶硫酸镁中![]() 的质量分数
的质量分数![]() ;
;
本题答案为:6.4![]() 。
。


科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.
回答下列问题:
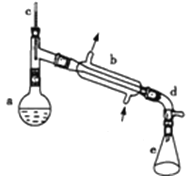
(1)由环己醇制取环己烯的反应类型为_________;
(2)装置b的冷凝水方向是______(填下进上出或上进下出);
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为____.
(5)在分离提纯中,使用到的仪器f名称是_____,分离氯化钙的操作是_____.
(6)合成过程中加入浓硫酸的作用是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是Z
C.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol
D.同温下,体积相同的两容器分别充2gY气体和4 gZ气体,则其压强比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前20号元素W、X、Y、Z的原子序数依次增大,W、X、Y三种元素所在周期序数之和等于7,这四种元素可组成中学常见的离子化合物ZYWX,其常用于检测溶液中的某种金属阳离子;W、X、Y组成一种共价化合物分子(X![]() W—Y—Y—W
W—Y—Y—W![]() X),该分子中每个原子最外层都达到8电子稳定结构。下列推断正确的是( )
X),该分子中每个原子最外层都达到8电子稳定结构。下列推断正确的是( )
A.W的氢化物的熔点一定比X的低
B.Z2Y是只含一种化学键的离子化合物
C.Y的氧化物对应的水化物一定是强酸
D.简单离子的半径大小:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如图转化关系:

下列说法正确的是
A. 异丙烯苯分子中所有碳原子一定共平面
B. 异丙烯苯和乙苯是同系物
C. 异丙苯与足量氢气完全加成所得产物的一氯代物有6种
D. 0.05mol异丙苯完全燃烧消耗氧气13.44L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为2CH3OH+3O2+4KOH==2K2CO3+6H2O。下列说法正确的是( )

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH - 6e- +2H2O=CO32- +8H+
C.甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g
D.反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com