
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
分析 [实验一]
(2)镁铝合金在空气中被氧气氧化生成氧化铝和氧化镁,与酸反应开始生成气体速率慢;
(3)测定铝的含量,利用铝和氢氧化钠溶液反应,镁和氢氧化钠溶液不反应,需要称量剩余镁的质量或测定反应消耗或剩余的NaOH的量或测定生成的NaAlO2的量;
[实验三]取少量实验二所得溶液于试管A中,加入过量的NaOH溶液,根据有白色沉淀生成判断Mg2+的存在;
用滴管将试管A中上层清液转移至试管B,滴加盐酸,根据先有白色沉淀生成,后白色沉淀溶解判断Al3+的存在.
[实验四]铝热反应本质是置换反应,金属性Mg>Al>Fe,所以发生Al与Fe2O3反应,置换出铁.
解答 解:[实验一]
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)镁铝合金在空气中被氧气氧化生成氧化铝和氧化镁,与酸反应开始生成气体速率慢;
故答案为:合金表面有氧化膜;
(3)②测定铝的含量,利用铝和氢氧化钠溶液反应,镁和氢氧化钠溶液不反应,需要称量剩余镁的质量或测定反应消耗或剩余的NaOH的量或测定生成的NaAlO2的量
故答案为:“测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量”;
[实验三]取少量实验二所得溶液于试管A中,加入过量的6mol•L-1NaOH溶液,充分振荡,静置,有白色沉淀产生,说明浸取液中含有Mg2+;
用滴管将试管A中上层清液转移至试管B,滴加0.1mol•L-1盐酸至过量,边加边振荡,有白色沉淀生成,后白色沉淀溶解,说明Al3+的存在,
故答案为:
| 实验操作 | 预期现象和结论 |
| 步骤1:取少量实验二所得溶液于试管A中,向试管A中滴加过量1 mol•L-1NaOH溶液,充分振荡,静置 | 有白色沉淀产生,说明溶液中含Mg2+ |
| 步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中逐滴滴加1 mol•L-1HCl至过量,边滴边振荡 | 有白色沉淀产生然后沉淀又溶解,说明溶液中含Al3+ |
点评 本题考查铝热反应、离子检验、实验方案的设计等,属于拼合型题目,难度中等,注意铝热反应本质为置换反应,是对学生综合能力的考查,注意Mg2+、Al3+离子的性质和分离的应用.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
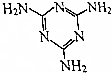 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| B. | FeSO4 | CuSO4 | 加入NaOH溶液,过滤 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀指不纯金属接触到的电解质溶液进行化学反应而损耗的过程 | |
| B. | 电化腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 | |
| C. | 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 | |
| D. | 金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
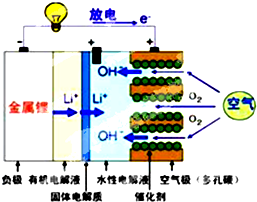 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A. | 负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 | |
| B. | 正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 | |
| C. | 在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 | |
| D. | 锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
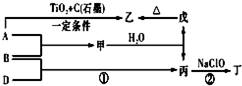 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).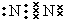 .写出丙的结构式
.写出丙的结构式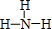 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com