
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| B. | FeSO4 | CuSO4 | 加入NaOH溶液,过滤 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钙不溶于水,硝酸钠溶于水;
B.二者均与NaOH反应生成沉淀;
C.酒精与水不分层;
D.硝酸银与NaCl反应生成沉淀和NaCl.
解答 解:A.碳酸钙不溶于水,硝酸钠溶于水,则溶解、过滤、蒸发可分离,故A正确;
B.二者均与NaOH反应生成沉淀,不能除杂,应加足量铁粉、过滤,故B错误;
C.酒精与水不分层,应加四氯化碳、萃取分液,故C错误;
D.硝酸银与NaCl反应生成沉淀和NaCl,引入新杂质NaCl,应加KCl、过滤,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,注意元素化合物知识的综合应用,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.92g | B. | 0.69g | C. | 0.46g | D. | 0.23g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3molH2+2molN2 | B. | 2molNH3+1molN2 | ||
| C. | 3molN2+1molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
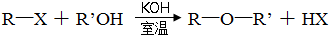 ,
,
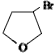 ,D
,D ,E
,E .
.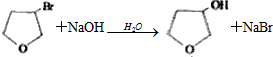 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com