
 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
| ||
| ||


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | 水.浓缩菠萝汁.蔗糖.柠檬酸.黄原胶.甜蜜素.维生素C,菠萝香精.柠檬黄.日落黄.山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Si-O | O═O | Si-Si |
| 键能/kJ?mol-1 | x | 498.8 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:
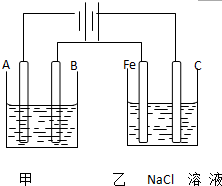 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com