
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、X占混合气体的体积分数不变 |
| B、单位时间生成a molX,同时生成3a molY |
| C、X、Y、Z的浓度不再变化 |
| D、X、Y、Z的分子数比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);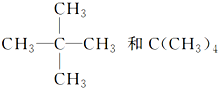
| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
.写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7种 | B、8种 | C、9种 | D、10种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com