
【题目】下列有机物描述正确的是( )
A. 含有苯环的有机物属于芳香烃
B. (CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3的名称是2-甲基-5-乙基辛烷
C. ![]() 命名为2-乙基丙烷
命名为2-乙基丙烷
D. CH2=CH2和![]() 在分子组成上相差一个CH2,两者互为同系物
在分子组成上相差一个CH2,两者互为同系物
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为0.1mol/L和0.3mol/L,则10min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2mol/LB.SO2为0.25mol/L
C.SO3为0.4mol/LD.SO2、SO3均为0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质,回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 ______ 。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 ______
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 ______ 。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 ______(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 ______(填离子符号),反应的离子方程式为 ______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ______ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是 ______ ,生成沉淀的原因是 ______(用平衡移动原理解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.Na2S2O3溶液与稀H2SO4反应:S2O32-+6H+=2S↓+3H2O
B.在海带灰的浸出液中滴加H2O2得到I2:2I+H2O2+2H+=I2+O2↑+2H2O
C.向 NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲溶液加入(或通入)物质乙(乙物质为气体或溶液),生成沉淀的质量与消耗乙的质量关系曲线符合图的是

A.向Na[Al(OH)4]溶液中通入二氧化碳
B.向Na[Al(OH)4]溶液中滴加盐酸
C.向澄清石灰水中通入二氧化碳
D.向Al2(SO4)3溶液中滴加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
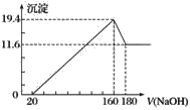
(1)合金中镁的质量是__________。
(2)所用盐酸的物质的量浓度是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com