
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为0.1mol/L和0.3mol/L,则10min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2mol/LB.SO2为0.25mol/L
C.SO3为0.4mol/LD.SO2、SO3均为0.15mol/L
【答案】0.03mol/(L.min) 75% AC B
【解析】
(1)
所以SO2起始物质的量浓度为0.4mol/L,
10min生成SO3的化学反应速率为![]()
SO2的转化率为![]()
(2)A.增大反应物浓度加快反应速率,A项正确;
B.降低温度,化学反应速率减慢,B项错误;
C.催化剂降低反应活化能,加快化学反应速率,C项正确;
D.反应为可逆反应,不可能完全转化,D项错误,
故答案为:A、C;
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,
所以反应达到平衡时,c(SO3)<0.4mol/L,
A.起始时或者完全转化为c(O2)=0.2mol/L,不是平衡时,A项错误;
B.c(SO2)=0.25mol/L,较为符合,B项正确;
C.起始时完全转化时才存在c(SO3)=0.4mol/L,C项错误;
D.不妨设反应到达平衡时O2转化xmol/L,则平衡时c(SO2)=0.2+2x,c(O2)=0.1+x,若平衡时c(SO2)=c(O2),则有0.2+2x=0.1+x,可得x=-0.1,不符合实际,D项错误,
答案选B;


科目:高中化学 来源: 题型:
【题目】I.将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
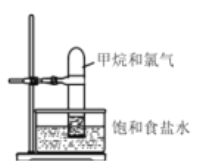
(1)油状液滴中属于非极性分子的电子式为________。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制________与水的反应。试管内液面上升的原因是________极易溶于水。
II.乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
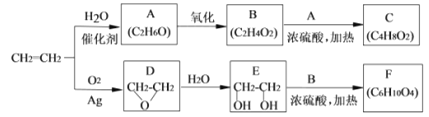
请回答下列问题:
(3)A的名称是________,含有的官能团名称是________。实验室A转化为乙烯的反应条件为________。
(4)B和A反应生成C的化学方程式为________,该反应的类型为________。
(5)F的结构简式为______________。
(6)写出D的同分异构体的结构简式__________________。
(7)乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。写出乙炔合成聚氯乙烯的合成路线。(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)______________
……目标产物)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
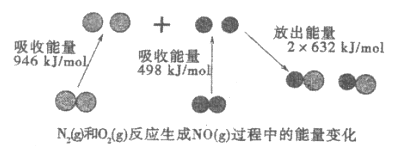
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是![]()
![]()

A. a为直流电源的正极
B. 若有1mol离子通过A膜,理论上阳极生成![]() mol气体
mol气体
C. 工作时,乙池中溶液的pH不变
D. 阴极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、海水是可以综合利用的。从海水中提取食盐和溴的过程:

(1)请写出一种海水淡化的方法________________________。
(2)步骤Ⅰ获取Br2的离子方程式为_________________________________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是________(填化学式)。
Ⅱ、海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘的实验步骤:
①用剪刀剪碎海带,用酒精湿润,放入坩埚中。
②灼烧海带至完全成灰,停止加热,冷却。
③将海带灰加蒸馏水溶解,搅拌、煮沸、过滤。
④在滤液中滴加稀硫酸及过氧化氢,然后加入几滴淀粉溶液,(涉及反应的离子方程式为2I-+H2O2+2H+=I2+2H2O)。
能证明海带中含有碘的实验步骤是________(填序号),现象是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物描述正确的是( )
A. 含有苯环的有机物属于芳香烃
B. (CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3的名称是2-甲基-5-乙基辛烷
C. ![]() 命名为2-乙基丙烷
命名为2-乙基丙烷
D. CH2=CH2和![]() 在分子组成上相差一个CH2,两者互为同系物
在分子组成上相差一个CH2,两者互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com