
| A. | 在25℃的蒸馏水中,FeS的溶解度最大 | |
| B. | 25℃时,CuS的饱和溶液中Cu2+的浓度约为1.14×10-18 mol•L-1 | |
| C. | 可用FeS固体作沉淀剂除去废水中的Cu2+ | |
| D. | 向物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成 |
分析 A.同类型的难溶电解质,Ksp小的溶解度小;
B.Cu2+的浓度为$\sqrt{Ksp}$;
C.由Ksp可知,CuS比FeS更难溶;
D.Ksp小的先沉淀.
解答 解:A.同类型的难溶电解质,Ksp小的溶解度小,则在25℃的蒸馏水中,FeS的溶解度最大,故A正确;
B.Cu2+的浓度为$\sqrt{Ksp}$=$\sqrt{1.3×1{0}^{-36}}$≈1.14×10-18 mol•L-1,故B正确;
C.由Ksp可知,CuS比FeS更难溶,则可用FeS固体作沉淀剂除去废水中的Cu2+,发生沉淀的转化,故C正确;
D.Ksp小的先沉淀,则向物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,先有ZnS沉淀生成,也生成FeS沉淀,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp与溶解度的关系、Ksp计算为解答的关键,侧重分析与计算能力的考查,注意选项D中Ksp小的先沉淀,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆腐、肉冻、果冻的生产 | B. | 工厂中设置的静电除尘装置 | ||
| C. | 河流入海口处三角洲的形成 | D. | 大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
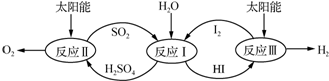
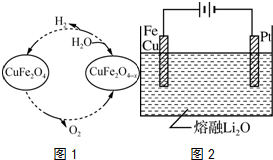
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
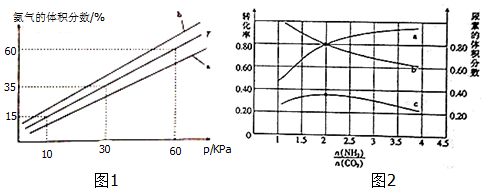
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com