
【题目】已知某烷烃分子中电子总数为42。
(1)该烷烃的分子式为_____________________________________。
(2)写出该烷烃分子的所有同分异构体的结构简式______________________。
(3)上述同分异构体中,在相同条件下沸点最低的是______________________________(写结构简式)。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
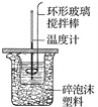
(1)烧杯间填满碎纸屑的作用是____________。
(2)要重复进行三次实验的目的是_____________。
(3)烧杯若不盖泡沫塑料板,求得的中和热数值将________(填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),理由是_______。
(5)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.5 ℃。则最终代入计算式的温度差的平均值为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
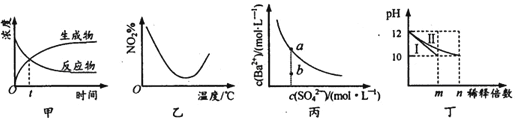
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
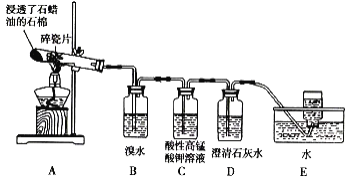
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______;乙的结构简式为____。
4乙,则甲的分子式为______;乙的结构简式为____。
(2)B装置中的实验现象是______。
(3)C装置中的实验现象是_____,其中发生反应的反应类型是___。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_(填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____(填序号,下同);除去甲烷中乙烯的方法是____。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(A1P)熏蒸杀虫,A1P遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05 mgkg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100 g原粮,E 中加入20.00mL2.50×l0-4molL-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
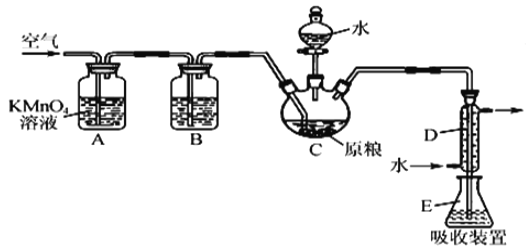
(1)装置A中的KMnO4溶液的作用是_____。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量______________________(填“偏髙”“偏低”或“不变”)。
(3)装置E中PH3氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:___________
(4)收集装置E中的吸收液,加水稀释至250 mL,量取其中的25.00 mL于锥形瓶中, 用4.0×l0-5molL-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00mL,反应原理是 SO32-+MnO4-+H+→SO42-+Mn2++H20(未配平)通过计算判断该样品是否合格(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
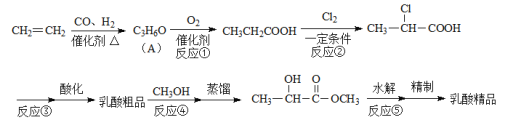
完成下列填空:
(1)乳酸中的官能团名称是__________________。A的结构简式是_____________________。
(2)反应②的反应类型是____________________。反应③的条件是_____________________。
(3)反应④的化学方程式为_______________________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:
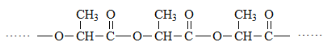
聚乳酸降解时,会产生自催化效应(降解的速度会越来越快),请解释原因。___________________________________________________________。
(5)设计一条由丙烯制备丙酸的合成路线。________________________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com