
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
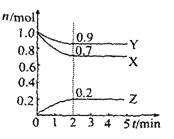
(1)该反应的化学方程式为:_____
(2)反应开始至2min,用Z表示的平均反应速率为:____
(3)下列叙述能说明上述反应达到化学平衡状态的是____(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:____
②加入催化剂:____
③增大容器的体积:____
【答案】3X + Y![]() 2Z 0.05 mol·L-1·min-1 AB 减小 增大 减小
2Z 0.05 mol·L-1·min-1 AB 减小 增大 减小
【解析】
利用坐标图象推断X、Y、Z发生反应的化学方程式时,首先从图象的起点切入,依据物质的量的变化趋势确定反应物和生成物,其次利用各物质的物质的量的变化量,确定化学计量数,最后依据反应结束后是否存在某一物质的量为0,确定反应是可逆反应还是不可逆反应。利用某量判断平衡状态时,需分析题中所给的量是常量还是变量,变量不变是平衡状态;分析条件改变对反应速率的影响时,需分析条件改变后,能否引起分子碰撞次数的增大或活化能的降低。
(1)从反应起点看,X 、 Y为反应物,Z为生成物;从变化量之比等于化学计量数之比分析,化学计量数为3X+ Y→2Z;从反应的最终结果看,没有一种物质的物质的量为0,所以反应可逆,因此该反应的化学方程式为:3X + Y![]() 2Z。答案为:3X + Y
2Z。答案为:3X + Y![]() 2Z;
2Z;
(2)反应开始至2min,用Z表示的平均反应速率为: =0.05 mol·L-1·min-1。答案为:0.05 mol·L-1·min-1;
=0.05 mol·L-1·min-1。答案为:0.05 mol·L-1·min-1;
(3)A.随着反应的进行,混合气体的总物质的量减小,当物质的量不变时,反应达平衡状态,A符合题意;
B.随着反应的进行,气体的总物质的量不断减小,混合气体的压强不断减小,当混合气体的压强不变时,气体的物质的量不变,反应达平衡状态,B符合题意;
C.不管反应是否达平衡,单位时间内每消耗3mol X,同时生成2mol Z,此时反应不一定达平衡状态,C不合题意;
D.不管反应进行到什么程度,混合气体的总质量都保持不变,所以混合气体总质量不变时,不一定达平衡状态,D不合题意;
故选AB。答案为:AB;
(4) ①降低温度:反应物的能量降低,有效碰撞次数减少,反应速率减小;
②加入催化剂:降低反应的活化能,增大活化分子百分数,化学反应速率加快;
③增大容器的体积:减小反应混合物的浓度,分子有效碰撞的次数减少,反应速率减慢;
答案为:减小;增大;减小。


科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
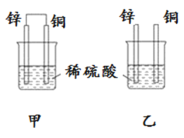
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
(2)同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
(3)请写出甲乙图中构成原电池的负极电极反应式:__________________。
(4)当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
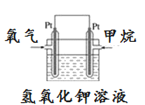
(5)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出正极的电极反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是
A. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
B. CH2=CH2+Br2 ![]() BrCH2CH2Br
BrCH2CH2Br
C. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D. CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物I的合成路线如图所示:

已知:
ⅰ.R-HC=CH-R’+R”COOH![]()
ⅱ.R-HC=CH-R”![]() (以上R、R’、R”代表氢、烷基或芳基等)。
(以上R、R’、R”代表氢、烷基或芳基等)。
回答下列问题:
(1)反应①的反应类型是___。
(2)写出反应②的化学方程式是___。
(3)合成过程中设计步骤①和④的目的是___。
(4)试剂a是___。
(5)下列说法正确的是___(选填字母序号)。
a.物质A极易溶于水 b.③反应后的试管可以用硝酸洗涤
c.F生成G的反应类型是取代反应 d.物质D既能与盐酸反应又能与氢氧化钠钠溶液反应
(6)由F与I2在一定条件下反应生成G的化学方程式是___;此反应同时生成另外一个有机副产物且与G互为同分异构体,此有机副产物的结构简式是___。
(7)已知:RCH2Br![]() R-CH=CH-R1
R-CH=CH-R1
以乙烯起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料.
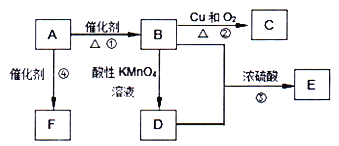
(1)A的结构式为________,C的名称为________。
(2)B分子中的官能团名称是________,请设计一种验证B物质存在该官能团的方法________。
(3)写出下列反应的化学方程式并指出反应类型:
①________;反应类型是________;
④________;反应类型是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃的说法正确的是

A. 该烃分子中共面的碳原子最多为14个
B. 该烃分子中共直线的碳原子只有为4个
C. 该烃存在顺反异构
D. 1mol 该烃与溴水反应时最多可以消耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
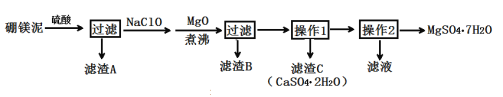
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列几种有机物:①乙炔、②乙醇、③乙醛、④乙酸、⑤甲酸乙酯、⑥苯酚、⑦溴乙烷。其中: 能与 Na2CO3 溶液反应产生气泡的是___(填序号,下同);遇氯化铁溶液呈紫色的是________;能发生银镜反应的是_____;不能使酸性 KMnO4 溶液褪色的是______。
(2)按要求写出下列反应方程式
①实验室制取乙炔:____________
②实验室制取乙烯:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。
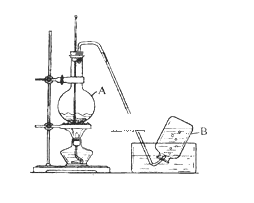
(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com