
| �¶�/�� | 200 | 250 | 300 | 350 |
| ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
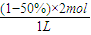 =1mol/L��C��Y��=
=1mol/L��C��Y��=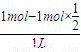 =0.5mol/L��c��Z��=c��W��=
=0.5mol/L��c��Z��=c��W��=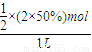 =0.5mol/L��k=
=0.5mol/L��k=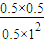 =0.5���������¶���350�棬�ʴ�Ϊ��350�森
=0.5���������¶���350�棬�ʴ�Ϊ��350�森


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 200 | 250 | 300 | 350 |
| ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�콭��ʡ�γ���ѧ������һ��ģ�⿼�Ի�ѧ�Ծ� ���ͣ������
��12�֣���1���п�ѧ���������ɫ���ɡ��Ĺ��룺��CO2��Ϊȼ�ϻ��л���ѧƷ���乹��ֳ�3�����裺
�� ����Ũ̼�����Һ���տ����е�CO2��
�� ���ڢٲ�����Һ������H2��O2��ͬʱ�����CO2��
�� ���ڢڲ�������H2��CO2��һ��������ת����CH4��ˮ������
��֪��H2��g��+0.5O2��g��=H2O��l�� ��H1=" ��285.8" kJ/mol
CH4��g��+2O2��g��=CO2��g��+2H2O��l�� ��H2=" ��889.6" kJ/mol
H2O��l��=H2O��g�� ��H3=" +44.0" kJ/mol
�ڢ۲���Ӧ���Ȼ�ѧ����ʽΪ ��
��2��ʹ�ú��ʵĴ����͵缫���ϣ���N2��H2Ϊԭ�ϣ���HCl-NH4ClΪ�������Һ��������ȼ�ϵ�أ�ͬʱ�ﵽ�̵����á��õ�ص�������ӦʽΪ ����Һ��H+�� ���ƶ���ѡ����д��������������
��3��ij��������Ҫ�ɷ���FeO��Fe2O3����������Fe2+��Fe3+�����ʵ���֮��Ϊ1:2ʱ�����������ߡ���Fe2O3Ϊԭ���Ʊ������������������м�������̿�ۣ��������·�Ӧ��
2Fe2O3��C 4FeO��CO2��Ϊ�Ƶ����ֻ�����ߵĴ�����Ӧ��480 g Fe2O3��ĩ�м���̿�۵�����Ϊ_____g��
4FeO��CO2��Ϊ�Ƶ����ֻ�����ߵĴ�����Ӧ��480 g Fe2O3��ĩ�м���̿�۵�����Ϊ_____g��
��4����T��ʱ����2L�̶�������ܱ������м���4 mol A��2 mol B���������·�Ӧ��
2A(g) + B(g)  C(g) + D(g) ��H =" Q" kJ��mol��1
C(g) + D(g) ��H =" Q" kJ��mol��1
����Ӧ�ﵽƽ��ʱ��A��ת����Ϊ50����
��������һ�������£���Ӧ�����Է����ҽ��У���֪Q __________0 (�����������������)��
������ά���¶Ȳ��䣬����������м�������ʼ������£�ʹ��ʼʱv��������v���棩�Ҵﵽƽ��ʱC�İٷֺ���Ϊ20�������з���Ҫ�����
A��2 mol A��1 mol B B��1 mol He��3 mol A��1.5 mol B��0.5molC��0.5mol D
C��2 mol C��2 mol D D��2 molA��1mol B��1 mol C��1 mol D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ������һ��ģ�⿼�Ի�ѧ�Ծ� ���ͣ������
��12�֣���1���п�ѧ���������ɫ���ɡ��Ĺ��룺��CO2��Ϊȼ�ϻ��л���ѧƷ���乹��ֳ�3�����裺
�� ����Ũ̼�����Һ���տ����е�CO2��
�� ���ڢٲ�����Һ������H2��O2��ͬʱ�����CO2��
�� ���ڢڲ�������H2��CO2��һ��������ת����CH4��ˮ������
��֪��H2��g��+0.5O2��g��=H2O��l�� ��H1= ��285.8 kJ/mol
CH4��g��+2O2��g��=CO2��g��+2H2O��l�� ��H2= ��889.6 kJ/mol
H2O��l��=H2O��g�� ��H3= +44.0 kJ/mol
�ڢ۲���Ӧ���Ȼ�ѧ����ʽΪ ��
��2��ʹ�ú��ʵĴ����͵缫���ϣ���N2��H2Ϊԭ�ϣ���HCl-NH4ClΪ�������Һ��������ȼ�ϵ�أ�ͬʱ�ﵽ�̵����á��õ�ص�������ӦʽΪ ����Һ��H+�� ���ƶ���ѡ����д��������������
��3��ij��������Ҫ�ɷ���FeO��Fe2O3����������Fe2+��Fe3+�����ʵ���֮��Ϊ1:2ʱ�����������ߡ���Fe2O3Ϊԭ���Ʊ������������������м�������̿�ۣ��������·�Ӧ��
2Fe2O3��C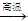 4FeO��CO2��Ϊ�Ƶ����ֻ�����ߵĴ�����Ӧ��480 g Fe2O3��ĩ�м���̿�۵�����Ϊ_____g��
4FeO��CO2��Ϊ�Ƶ����ֻ�����ߵĴ�����Ӧ��480 g Fe2O3��ĩ�м���̿�۵�����Ϊ_____g��
��4����T��ʱ����2L�̶�������ܱ������м���4 mol A��2 mol B���������·�Ӧ��
2A(g) + B(g)  C(g) + D(g) ��H = Q kJ��mol��1
C(g) + D(g) ��H = Q kJ��mol��1
����Ӧ�ﵽƽ��ʱ��A��ת����Ϊ50����
��������һ�������£���Ӧ�����Է����ҽ��У���֪Q __________0 (�����������������)��
������ά���¶Ȳ��䣬����������м�������ʼ������£�ʹ��ʼʱv��������v���棩�Ҵﵽƽ��ʱC�İٷֺ���Ϊ20�������з���Ҫ�����
A��2 mol A��1 mol B B��1 mol He��3 mol A��1.5 mol B��0.5molC��0.5mol D
C��2 mol C��2 mol D D��2 molA��1mol B��1 mol C��1 mol D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| �¶�/�� | 200 | 250 | 300 | 350 |
| ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com