
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如图1: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为、 .
(2)写出步骤①的化学方程式 .
(3)写出步骤②的离子方程式 .
(4)步骤③中化学反应可以发生的原因是 .
(5)过硼酸钠晶体(NaBO34H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结
晶水. 实验测得过硼酸钠晶体的质量随温度变化的情况如图2所示,则T2℃时所得晶体的化学式为 . 
【答案】
(1)NaHCO3;Na2SO4
(2)Mg2B2O5?H2O+2NaOH=2NaBO2+2Mg(OH)2↓
(3)2Na++4BO2﹣+2CO2+11H2O=Na2B4O7?10H2O↓+2HCO3﹣
(4)硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行
(5)NaBO3?3H2O
【解析】解:硼镁矿与氢氧化钠溶液反应,过滤除去杂质,NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O710H2O与为NaHCO3 , 过滤分离,由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O710H2O晶体与硫酸反应得到硼酸,溶液b中含有硫酸钠,硼酸晶体加热分解得到B2O3 , 最后用Mg还原得到粗硼.(1)由上述分析可知,第①步通入过量二氧化碳,则a为NaHCO3 , 第③步加入硫酸,b为Na2SO4 ,
所以答案是:NaHCO3;Na2SO4;(2)第①步为Mg2B2O5 . H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2 , 反应方程式为:Mg2B2O5H2O+2NaOH=2NaBO2+2Mg(OH)2 ,
所以答案是:Mg2B2O5H2O+2NaOH=2NaBO2+2Mg(OH)2;(3)NaBO2和二氧化碳反应生成Na2B4O710H2O和碳酸氢钠,离子方程式为2Na++4BO2﹣+2CO2+11H2O=Na2B4O710H2O↓+2HCO3﹣ , 所以答案是:2Na++4BO2﹣+2CO2+11H2O=Na2B4O710H2O↓+2HCO3﹣;(4)步骤③中化学反应可以发生的原因是:硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行,
所以答案是:硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行;(5)过硼酸钠晶体(NaBO34H2O)的物质的量= ![]() =0.2mol,T2°C质量变化为27.20g,质量变化30.8g﹣27.20g=3.6g,减少水的质量=
=0.2mol,T2°C质量变化为27.20g,质量变化30.8g﹣27.20g=3.6g,减少水的质量= ![]() =0.2mol,则1molNaBO34H2O失去水1mol,则T2℃时所得晶体的化学式为NaBO33H2O,
=0.2mol,则1molNaBO34H2O失去水1mol,则T2℃时所得晶体的化学式为NaBO33H2O,
所以答案是:NaBO33H2O;


科目:高中化学 来源: 题型:
【题目】将适当的数据填写在空格中:
(1)0.5molNaOH的质量是g,10gNaOH的物质的量是mol.
(2)在标准状况下0.5molH2的体积为L,在标况下5.6LH2的物质的量为mol.
(3)将58.5gNaCl溶于水配制成500mL溶液,此溶液中溶质的物质的量浓度为;取此溶液100mL,其中Na+的物质的量浓度为 , Na+的物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第4周期ⅥA族元素,下列叙述不正确的是( )
A. 硒是一种金属性很强的元素 B. 硒可以形成SeO2和SeO3
C. 硒的氢化物化学式为H2Se D. 硒的最高价氧化物对应水化物的化学式是H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(用化学式回答).
(4)②与④形成的原子个数比为1:2化合物的电子式为 .
(5)⑥的单质与①、④、⑤三种元素形成化合物的水溶液反应的离子方程式为: .
(6)②的最高价氧化物的熔沸点低于⑦的最高价氧化物的熔沸点,原因是 .
(7)⑤元素与⑨元素形成的化合物中,化学键类型为 , 高温灼烧该化合物时,火焰呈色.
(8)在②、③、⑦、⑧单质中,符合下列转化关系的是:(填元素符号).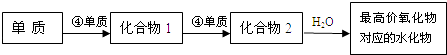
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com