
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g) ![]() 2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
A.最终可以生成2molNH3
B.达到化学平衡状态时,正反应和逆反应的速率都为0
C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2
D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 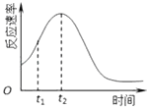
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如图1: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为、 .
(2)写出步骤①的化学方程式 .
(3)写出步骤②的离子方程式 .
(4)步骤③中化学反应可以发生的原因是 .
(5)过硼酸钠晶体(NaBO34H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结
晶水. 实验测得过硼酸钠晶体的质量随温度变化的情况如图2所示,则T2℃时所得晶体的化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)2SO3(g) 最终能增大反应速率的措施是( )
A.降低体系温度
B.增大容器容积
C.减小O2的浓度
D.升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl –
B. c(H+)/ c(OH–) = 1×10 -12的溶液中: K+、Na +、![]() 、
、![]()
C. c(Fe2+ ) =1 mol·L-1的溶液中: K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中: Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com