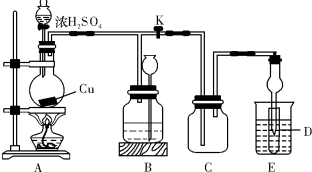
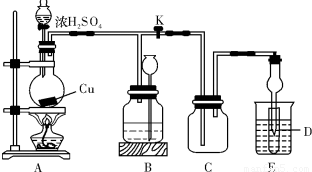
解:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字;装置E中试管D内盛品红溶液,当C中气体集满,D中有二氧化硫,二氧化硫能和有色物质品红溶液生成无色物质,故答案为:Cu+2H
2SO
4(浓)
CuSO
4+2H
2O+SO
2↑;品红溶液褪色;
(2)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,饱和NaHSO
3溶液符合要求,当二氧化硫不溶于B中应放置的液体时,气体使液体从试剂瓶中压到长颈漏斗中,
故答案为:试剂瓶中液面下降,长颈漏斗中液面上升;D;
(3)直到反应完毕,最后发现烧瓶中还有一定量的H
2SO
4和Cu剩余,说明一定剩余稀硫酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,根据金属活动顺序表铁能和稀硫酸反应,但银不能,稀硫酸不与BaCl
2溶液,但与饱和NaHSO
3溶液反应生成二氧化硫,故答案为:AD;
(4)铜和氧气、稀硫酸发生氧化还原反应,得到硫酸铜和水,反应为2Cu+O
2+2H
2SO
4═2CuSO
4+2H
2O,
故答案为:2Cu+O
2+2H
2SO
4═2CuSO
4+2H
2O.
分析:(1)根据铜是金属,具有还原性,浓硫酸具有强氧化性;当C中气体集满,D中逸出二氧化硫;
(2)根据各装置的用途和反应原理解答;
(3)根据金属活动顺序表和复分解反应的条件进行解答;
(4)稀硫酸和铜不发生反应,有氧气能反应.
点评:本题考查了浓硫酸的性质应用,关键是理解掌握二氧化硫的性质,难度不大.


 CuSO4+2H2O+SO2↑;品红溶液褪色;
CuSO4+2H2O+SO2↑;品红溶液褪色;