
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。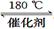
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下: NO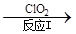 NO2
NO2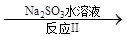 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1/ 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol
(2)增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等
(3)2NO2 + 4 Na2SO3=N2 + 4 Na2SO4 67.5 (4)①0.56 ② 减少CO2浓度 ③ <
解析试题分析:(1)(①+②)÷2可得CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol。(2)由于反应 的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数
的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数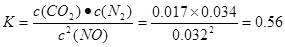 .②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,
.②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3, <0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0.
<0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0.
考点:考查化学方程式、热化学方程式的书写、化学平衡常数的计算、外界条件对化学平衡移动的影响。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。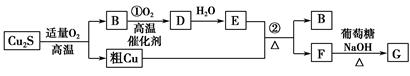
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x= ;y= 。
(2)配平该反应的方程式:
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是 。
(4)用双线桥法表示该反应中的电子转移方向和数目: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)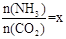 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。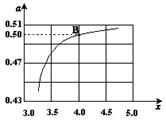
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3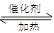 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)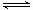 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g)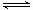 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g)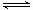 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。[来源:Z|xx|k.Com]
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)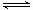 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。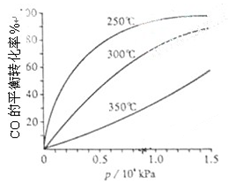
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3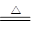 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2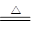 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg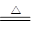 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐、碳酸钠和碳酸氢钠是生活中常见的钠盐。请回答下列问题。
(1)碳酸氢钠的水溶液显__________性。(填“酸”、“碱”或“中”)。除去碳酸钠固体中混有的少量碳酸氢钠,反应的化学方程式为_________________。
(2)等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成的CO2量,前者________后者(填“>”、“<”或“=”)。
(3)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量a、加过量NaOH、加过量b、过滤、加适量盐酸,蒸发结晶得到“化学纯”级的NaCl固体。试剂a、b分别是________(填序号)
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
(4)工业上用电解饱和食盐水的方法生产氯气和烧碱。
①某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理_________________________________(用离子方程式表示)。
②工业上可用氨检验输送氯气的管道是否漏气。反应方程式如下: 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com