
| ①×2+②+③ |
| 2 |


科目:高中化学 来源: 题型:
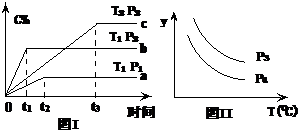 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、E(4s)>E(3s)>E(2s)>E(1s) |
| B、E(3d)>E(4s)>E(3p)>E(3s) |
| C、E(5s)>E(4f)>E(4s)>E(3d) |
| D、E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d<c<a<b |
| B、c<d<b<a |
| C、d<a<b<c |
| D、c<d<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
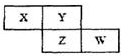 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氩原子的氩气在标准状况下的体积约为11.2 L |
| B、17g 氨气含有的电子数为10NA |
| C、18g D2O中含有的氧原子数为NA |
| D、标准状况下,22.4LCCl4含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com