


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
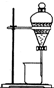 某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.
某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 把一定质量的镁、铝混合物投入到一定体积1mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol?L-1的氢氧化钠溶液,生成的沉淀与加入氢氧化钠溶液的体积关系如图所示.假设该过程中生成沉淀的最大量为0.03mol则:
把一定质量的镁、铝混合物投入到一定体积1mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol?L-1的氢氧化钠溶液,生成的沉淀与加入氢氧化钠溶液的体积关系如图所示.假设该过程中生成沉淀的最大量为0.03mol则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com