
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
| 1×10-12 |
| 1×10-8 |
| 1 |
| 2 |
| 1×10-12 |
| 1×10-8 |
| 1 |
| 2 |
| 5×10-5mol/L×2×3L-1×c(H+) |
| 4L |
| 4mL |
| 20mL |
| 10-12 |
| 10-7 |
| 1 |
| 2 |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持温度和容器压强不变,充入1 mol NH3(g) |
| B、保持温度和容器体积不变,充入1 mol NH3(g) |
| C、保持温度和容器压强不变,充入1 mol N2(g) |
| D、保持温度和容器压强不变,充入1 mol Ar(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在CCl4中的溶解性BrCl<Br2 |
| B、BrCl能使润湿的淀粉碘化钾试纸变蓝 |
| C、BrCl氧化性比Br2强 |
| D、常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
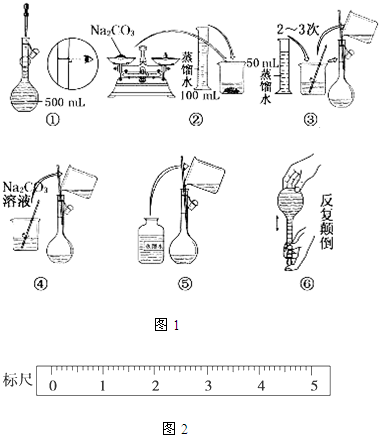
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com