
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。(共14分)
(1)将黄铜矿粉碎、升高温度、增大空气流速等(2分)[对一点给1分]
(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)[配平错误或化学式写错0分]
CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种(2分)
(3)1×10-5 mol/L(2分)
取一小片pH试纸放在玻璃片或表面皿上,用玻璃捧或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH值。(2分)
(4) 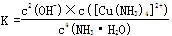 (2分)
(2分)
(5)降低G的溶解度,促进深蓝色晶体析出(2分)
解析试题分析:
(1)增大同体接触面积,升高温度,增大空气流速即增大氧气浓度均能加快化学反应速率。
(2)从数据看,除去铁元素,应将+2价铁转化为+3价铁,加入双氧水可达到此目的。Fe3+水解能力比Cu2+强:Fe3++3H2O Fe(OH)3+3H+,加入氧化铜、氢氧化铜、碳酸铜或碱式碳酸铜等消耗生成的酸,促使Fe3+完全水解,过滤除去过量的CuO和氢氧化铁即可。
Fe(OH)3+3H+,加入氧化铜、氢氧化铜、碳酸铜或碱式碳酸铜等消耗生成的酸,促使Fe3+完全水解,过滤除去过量的CuO和氢氧化铁即可。
(3)由电离常数表达式计算可得。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。
考点:本题以工艺流程为基础,考查了化学实验基本操作、氧化还原理论、化学平衡理论等相关知识。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9,请回答: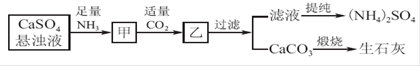
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,
③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程: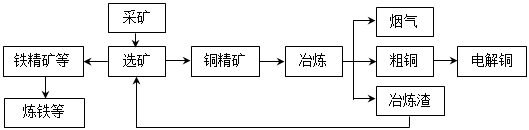
冶炼中的主要反应:Cu2S + O2 =" 2Cu" + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水中含有CN-和Cr2O 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+ SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=_________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式_____________________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+) = 2.5×10-2 mol·L-1,除OH—之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为_____________________________。
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)  2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某温度(t ℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是
______________________________________________________________。
(2)若所得混合溶液的pH=2,则a∶b=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com