
【题目】乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。

写出下列反应的化学方程式:
①______________________;
②_________________________;
③___________________________。
【答案】2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ CH3CH2OH+3O2![]() 2CO2+3H2O 2CH3CH2OH+O2
2CO2+3H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
根据题中转化关系,乙醇与氧气在铜作催化剂的条件下被氧化成C为CH3CHO,乙醇与钠反应生成A为CH3CH2ONa,乙醇点燃生成B为CO2,据此答题。
根据题中转化关系,乙醇与氧气在铜作催化剂的条件下被氧化成C为CH3CHO,乙醇与钠反应生成A为CH3CH2ONa,乙醇点燃生成B为CO2,反应①的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,反应②的化学方程式为CH3CH2OH+3O2![]() 2CO2+3H2O,反应③的化学方程式为2CH3CH2OH+O2
2CO2+3H2O,反应③的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3CH2OH+3O2
2CH3CHO+2H2O;故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3CH2OH+3O2![]() 2CO2+3H2O;2CH3CH2OH+O2
2CO2+3H2O;2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

则,A的化合价__B的化合价(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:


则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:__.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________________________.
(4)某配合物的分子结构如图所示,则N原子的杂化方式为__;基态Ni原子的电子排布式__.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应(C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O)产生的所有气体产物,选用了如下图所示的实验装置。
CO2↑+2SO2↑+2H2O)产生的所有气体产物,选用了如下图所示的实验装置。

(1)①中无水硫酸铜的作用是_______________________________________________。
(2)②中酸性KMnO4溶液的作用是___________________________________________。
(3)②中两次用到品红溶液,它们的作用分别是A____________,B____________。
(4)③中出现的现象是____________________________________________________,
发生反应的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
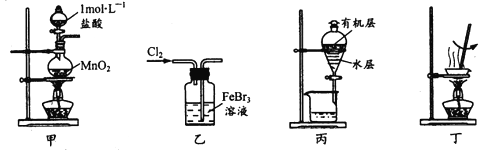
A. 用装置甲制取氯气
B. 用装置乙使Br- 全部转化为溴单质
C. 用装置丙分液时先从下口放出水层,再从上口倒出有机层
D. 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧
B.H2SO4与Cu反应
C.二氧化硫通入澄清石灰水
D.硫酸中加入锌粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com