
【题目】下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧
B.H2SO4与Cu反应
C.二氧化硫通入澄清石灰水
D.硫酸中加入锌粉
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。

写出下列反应的化学方程式:
①______________________;
②_________________________;
③___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
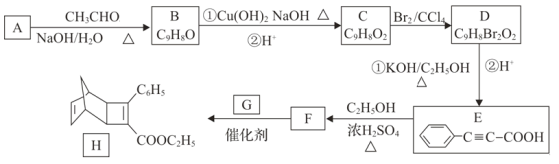
已知:①RCHO+CH3CHO![]()
![]()
![]() RCH=CHCHO
RCH=CHCHO
②![]()
③ +HCHO
+HCHO![]()
 +HCOO-
+HCOO-
回答下列问题:
(1)E中含氧官能团名称为_________非含氧官能团的电子式为_______。E的化学名称为苯丙炔酸,则B的化学名称为__________。
(2)C→D的反应类型为__________。B→C的过程中反应①的化学方程式为 ________。
(3)G的结构简式为_________。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式________。
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有五种不同化学环境的氢且个数比为1:1:2:2:4
(5)写出用甲醛和乙醇为原材料制备化合物C(CH2ONO2)4的合成路线(其他无机试剂任选,合成路线流程图示例见本题题干)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行反应:mA(气)+nB (气)![]() pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,
pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,![]() 随时间化过程均如图所示,则对该反应叙述正确的是
随时间化过程均如图所示,则对该反应叙述正确的是

A. 正反应是放热反应, m+n<p+q
B. 逆反应是放热反应, m+n﹥p+q
C. 正反应是放热反应, m+n﹥p+q
D. 逆反应是放热反应, m+n﹥p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:反应Ⅰ中所有金属元素均以离子形式存在。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应还原产物的化学式____。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(3)反应Ⅲ中X可以是______。(填字母代号)它的作用是______。
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阴极电极反应式_______________。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH__7(填“>”“=”或“<”),理由是____。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=_____。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3分两步,将步骤ii补充完整:

ⅰ.NO3+Fe+2H+=NO2+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3)为初始时NO3的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。

(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3,最终生成N2逸出。其装置及转化图如图所示:

①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法正确的是

A. Kb2的数量级为10-5
B. X(OH)NO3水溶液显酸性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间发生如下的转化:
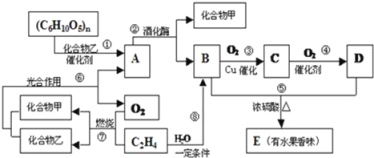
(1)写出D分子中官能团的名称:_____,C物质的结构简式:____.
(2)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是__________.
(3)请写出下列转化的化学反应方程式:
①(C6H10O5)n→A:_____; ②乙烯生成聚乙烯:_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com