
【题目】向![]() 未知浓度的
未知浓度的![]() 、
、![]() 混合溶液逐滴滴加
混合溶液逐滴滴加![]() 溶液,混合溶液的电导率(导电能力)如图所示,下列叙述错误的是( )
溶液,混合溶液的电导率(导电能力)如图所示,下列叙述错误的是( )

A.![]() 两点水的电离程度:
两点水的电离程度:![]()
B.原溶液中![]()
C.![]() 是
是![]() 恰好被
恰好被![]() 溶液中和的过程
溶液中和的过程
D.![]() 点:
点:![]()
【答案】D
【解析】
由图可知,随着加入氢氧化钠,导电率减小,当加入的NaOH溶液为10.00mL时,导电率最小,此时NaOH溶液恰好与HCl反应生成NaCl和H2O,b点溶液中溶质主要为NaCl和CH3COOH,接着再加入10.00mLNaOH溶液,与CH3COOH反应生成CH3COONa和H2O,c点溶液中溶质主要为CH3COONa和NaCl。
A. b点溶液中溶质主要为NaCl和CH3COOH,c点溶液中溶质主要为CH3COONa和NaCl, CH3COOH抑制水的电离,CH3COONa促进水的电离,水的电离程度:![]() ,A正确;
,A正确;
B. 0.100mol/L 10.00mLNaOH溶液与CH3COOH恰好反应生成CH3COONa和H2O,所以n(CH3COOH)=0.001mol,原溶液中c(CH3COOH)=![]() ,B正确;
,B正确;
C. 随着加入氢氧化钠,导电率减小,当加入的NaOH溶液为10.00mL时,导电率最小,此时NaOH溶液恰好与HCl反应生成NaCl和H2O,C正确;
D. c点溶液中溶质主要为CH3COONa和NaCl,其浓度大小为:![]() ,D错误;故答案为:D。
,D错误;故答案为:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有的Cr2O72-和CrO42-会对水体产生很大的危害,因此这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
CrO42—![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①中反应为2 CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O。
下列说法正确的是
A.①中,酸化后废水黄色变浅
B.②中,反应的氧化剂与还原剂的物质的量之比为3︰1
C.③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D.①中,所加酸可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v (N2)=0.2molL﹣1min﹣1B.v (N2)=5molL﹣1s﹣1
C.v (NH3)=0.1molL﹣1min﹣1D.v (H2)=0.3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 上层液体呈橙红色 | 氧化性: |
B | 向 | 白色沉淀不溶解 |
|
C | 向盛有 | 溶液变蓝绿色,试管底有红色沉淀 | 氧化性: |
D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化的铝滴落 | 生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10 mL 0.01 mol·L-1的H2N2O2溶液中滴加0.01 mol·L-1的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是

A.由a点到n点水的电离程度依次增大
B.a点时,c(H2N2O2)>c(Na+)
C.m点时,c(OH-)+c(N2O22-)=c(H2N2O2)+c(H+)
D.m点到n点,![]() 比值不变
比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两套实验装置,用于实验室制取乙酸乙酯和乙酸丁酯。下列说法错误的是
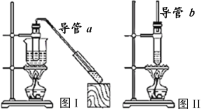
A.导管a和导管b的作用都是冷凝回流
B.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
C.加入过量的乙酸可以提高醇的转化率
D.图I装置用于制取乙酸乙酯,图Ⅱ装置用于制取乙酸丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于可逆反应的是( )
①N2+3H2![]() 2NH3,2NH3
2NH3,2NH3![]() 3H2+N2
3H2+N2
②2NaHCO3![]() Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH![]() CH2===CH2↑+H2O,CH2===CH2+H—OH
CH2===CH2↑+H2O,CH2===CH2+H—OH![]() CH3CH2OH
CH3CH2OH
④2Na+Cl2![]() 2NaCl, 2NaCl
2NaCl, 2NaCl![]() 2Na+Cl2
2Na+Cl2
A.只有①B.①②③
C.①②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com