
【题目】X、Y、Z三种短周期元素在周期表中的相对位置如下图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )

A. Z元素的氧化物对应的水化物一定是一种强酸
B. 在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
C. 三种元素原子半径的大小顺序为:X>Y>Z
D. Z的单质与 Fe 反应生成的化合物中,铁元素显+3价
【答案】B
【解析】
X、Y、Z三种短周期元素,根据元素周期表知,这三种元素是第二、三周期元素,Y位于第二周期,若Y原子的外层电子数是次外层电子数的3倍,则Y最外层有6个电子,则Y是O元素,X是N元素,Z是S元素,据此解答本题。
X、Y、Z三种短周期元素,根据元素周期表知,这三种元素是第二、三周期元素,Y位于第二周期,若Y原子的外层电子数是次外层电子数的3倍,则Y最外层有6个电子,则Y是O元素,X是N元素,Z是S元素;
A. Z是S元素,S元素的氧化物有SO2和SO3,其中SO2对应的水化物H2SO3是弱酸,故A错误;
B. 同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,Y的非金属性大于X,所以氢化物的稳定性X<Y,同主族从上到下非金属性依次减弱,Y的非金属性大于Z,所以氢化物的稳定性Z<Y,故B正确;
C. 原子的电子层数越多其原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,则原子半径大小顺序是Z>X>Y,故C错误;
D. S与Fe反应生成的是FeS,FeS中铁元素显+2价,故D错误。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】物质A~E均含同种元素,都是中学化学中常见的物质,C为蓝色不溶于水的固体,它们可发生如下图所表示的反应(除A~E外的其他物质已略去):

(1)写出相应物质的类别:
物质 | B | C | D |
类别 | ___________ | ______________ | ______________ |
(2)在以上反应中(用序号填空):
属于氧化还原反应的是________;属于复分解反应的是________。
(3)写出反应③和⑦的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述中正确的是
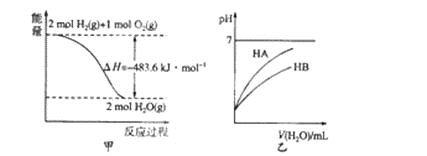
A. 图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量
B. 图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ
C. 图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D. 图乙中起始时HA的物质的量浓度大于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2![]() 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含CuSO4废水获得金属铜。当休持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时问变化的曲线如图所示。下列推论不合理的是

A. 由图可知,活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁屑为负极
C. 利用铁碳混合物回收含CuSO4废水中铜的反应原理:Fe+CuSO4=FeSO4+Cu
D. 增大铁碳混合物中铁碳质量比(x),一定会提高废水中Cu2+的去除速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A. 酸性B. 碱性C. 还原性D. 氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____,C原子的杂化形式为______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。
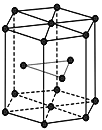
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com