
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
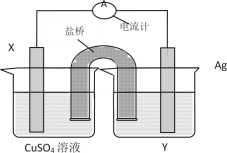
请回答下列问题:
(1)电解质溶液Y是__;
(2)X电极上发生的电极反应为__。
【答案】硝酸银溶液 Cu-2e-=Cu2+
【解析】
由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极.盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极)。
(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,负极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:Cu-2e-=Cu2+;


科目:高中化学 来源: 题型:
【题目】.下表是从实验中测得的不同物质中氧氧键的键长和键能数据:
氧氧键 |
|
|
|
|
键长 | 149 | 128 | 121 | 112 |
键能 |
|
|
|
|
其中![]() 、
、![]() 的值尚未测定,但可根据规律推导
的值尚未测定,但可根据规律推导![]() 、
、![]() 、
、![]() 、
、![]() 的大小顺序是
的大小顺序是![]() ,该规律是( )
,该规律是( )
A.成键时,电子数越多,键能越大
B.键长越短,键能越大
C.成键所用电子数越少,键能越大
D.成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
A.加入适量小苏打B.加入适量稀硝酸
C.加入适量烧碱固体D.加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
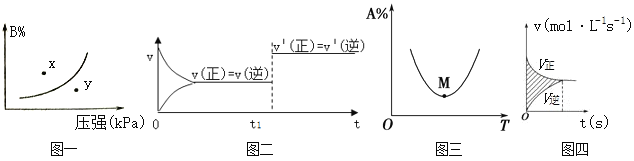
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
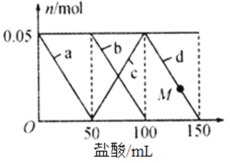
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期且相邻,Y的基态原子的s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的原子核外价电子排布式为![]() ,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:Y>X
B.简单离子的半径:Z>X>Y
C.Z的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由Y、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.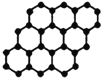 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NA
B.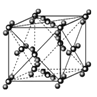 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元
C.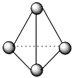 62gP4含有P-P键的个数为6NA
62gP4含有P-P键的个数为6NA
D.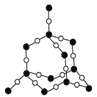 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由这几种元素组成的SCN-、CN-、F-等形成很多配合物。
(1)基态Fe原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为__;在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是__。
(3)配合物K4[Fe(CN)6]中不存在的作用力是__(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子__(用化学式表示),该分子的空间构型为__。
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是__。1mol(C2H5O)3P=O分子中含有的σ键的物质的量为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com