
【题目】对可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列图象正确的是( )
A.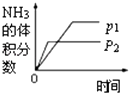
B.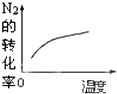
C.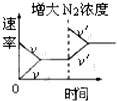
D.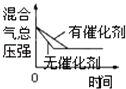
【答案】C
【解析】解:A、压强增大反应速率增大,先到达平衡,故压强P2>P1,增大压强平衡向气体体积减小的方向移动进行,氨气的体积分数增大,图象与实际不相符,故A错误;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低,图象中温度越高氮气的转化率越大,与实际不相符,故B错误;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动,图象与实际相符合,故C正确;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间,图象中没有使用催化剂到达平衡的时间短,与实际不符,故D错误,
故选C.
A、压强增大反应速率增大,平衡向气体体积减小的方向移动,氨气的体积分数增大;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( ) 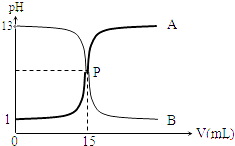
A.盐酸的物质的量浓度为1molL
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金材料在现代装饰材料中占有极为重要的地位,这种材料常用于制作门窗框、防护栏等。下列铝镁合金的性质与这些用途无关的是
A.不易生锈B.导电性好C.密度小D.强度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于生物体内化合物的说法不正确的是( )
A. 脂肪是既能贮能又具有保温作用的物质
B. 蛋白质是控制细胞生命活动的大分子
C. 无机盐离子可以维持内环境的渗透压
D. 核酸承担了遗传信息贮存和传递的任务
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。

①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铅[2PbCO3Pb(OH)2]是生产铅酸蓄电池正极的原料.
(1)某研究小组制备碱式碳酸铅的主要实验流程如图: 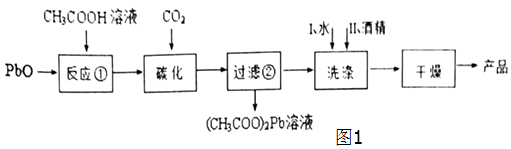 ①“反应①”的生成物是(CH3COO)2PbPb(OH)2 , 该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为
①“反应①”的生成物是(CH3COO)2PbPb(OH)2 , 该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为
②过滤时所志要的玻璃仪器有漏斗
③沉淀经水洗涤后又用洒精洗涤的目的是
(2)为确定2PbCO3Pb(OH)2的热分解过程,进行了如下实验: 称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如图所示.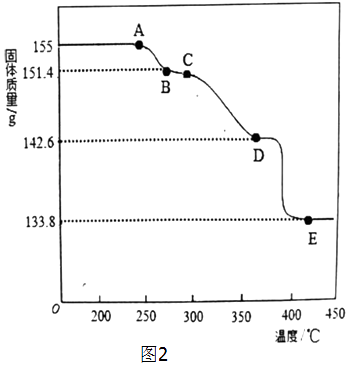
①A→B过程中,逸出的分解产物的化学式为;E点残留固体的化学式为
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A. 2 mol SO2和5 mol O2充分反应可生成2 mol SO3
B. 2 mol SO2和1mol O2达到化学平衡时SO2、O2、SO3的分子数之比一定为2∶1∶2
C. 达到化学平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D. 三种物质的浓度相等时,说明反应达到了化学平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚。

已知:
回答下列问题:
(1)写出A→B反应所需的试剂____________, A→B反应类型为__________。
(2)对于柳胺酚,下列说法正确的是________。
A.1 mol柳胺酚最多可以和2 mol NaOH反应 B.可发生水解反应
C.不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式___________________________________________。
(4)写出化合物F的结构简式______________________
(5)写出同时符合下列条件的F的同分异构体的结构简式_____________________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。_______________________
注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置做相应实验,收集方法及所加试剂、现象、结论均正确的是
选项 | 气体 | 试剂 | 现象 | 结论 |
|
A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 气体 | |
B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
C | NO2 | 淀粉一KI溶液 | 溶液变蓝色 | NO2有还原性 | |
D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com