
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚。

已知:
回答下列问题:
(1)写出A→B反应所需的试剂____________, A→B反应类型为__________。
(2)对于柳胺酚,下列说法正确的是________。
A.1 mol柳胺酚最多可以和2 mol NaOH反应 B.可发生水解反应
C.不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式___________________________________________。
(4)写出化合物F的结构简式______________________
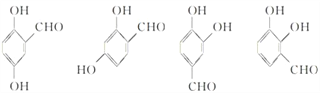
(5)写出同时符合下列条件的F的同分异构体的结构简式_____________________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
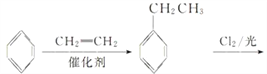
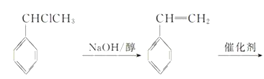
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。_______________________
注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
【答案】 浓硝酸/浓硫酸 取代反应(硝化反应) B、D ![]() +2NaOH
+2NaOH![]()
![]() +NaCl+H2O
+NaCl+H2O 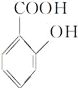
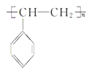
【解析】试题分析:由流程可知,苯与氯气发生取代反应生成A(氯苯),然后氯苯发生硝化反应生成B(对氯硝基苯),对氯硝基苯在碱性条件下发生水解生成C(对硝基苯酚钠),C经酸化转化为D(对硝基苯酚);D经还原生成E(对羟基苯胺),由柳胺酚的结构及E的结构可知,F为邻羟基苯甲酸。
(1)写出A→B反应所需的试剂浓硝酸/浓硫酸, A→B反应类型为取代反应(硝化反应)。
(2)对于柳胺酚的说法,A.柳胺酚分子中有2个酚羟基和1个酰胺键,它们都能与氢氧化钠反应,所以1 mol柳胺酚最多可以和3mol NaOH反应,A不正确; B.柳胺酚分子中有酰胺键,可发生水解反应,B正确;C.柳胺酚分子的苯环上还有可以被取代的H原子,所以能发生硝化反应 ,C不正确;D.柳胺酚分子的苯环上还有可以被取代的H原子,所以可与溴发生取代反应,D正确。综上所述,说法正确的是B、D。
(3)B→C的化学方程式. ![]() +2NaOH
+2NaOH![]()
![]() +NaCl+H2O。
+NaCl+H2O。
(4)写出化合物F的结构简式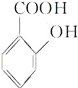 。
。
(5)①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应,要求分子中有醛基;同时符合这些条件的F的同分异构体有4种,其结构简式分别为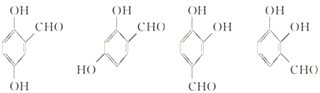 ,可以任意写出其中3种。
,可以任意写出其中3种。
(6)以苯和乙烯为原料可合成聚苯乙烯,首先,苯和乙烯发生加成反应生成乙苯,乙苯再与氯气发生侧链上的取代反应得到一氯代乙苯,一氯代乙苯再发生消去反应得到苯乙烯,最后苯乙烯发生加聚反应得到目标产品。具体合成路线如下: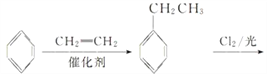
 。
。


科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯气的水溶液能导电,所以氯气是电解质
B.盐酸能导电说明盐酸是电解质
C.酒精在水溶液中和熔融状态下都不导电,酒精是非电解质
D.NaCl和H2SO4都是电解质,所以在熔融状态下一定能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。空气吹出SO2吸收法工艺流程如下:

(1)步骤③的离子方程式: _________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=+28.7kJmol﹣1
B.NaOH+HNO3=NaNO3+H2O△H=﹣28.7kJmol﹣1
C.NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=﹣57.4kJmol﹣1
D.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com