
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。空气吹出SO2吸收法工艺流程如下:

(1)步骤③的离子方程式: _________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因______________________________________________________________。
【答案】 Br2+SO2+2H2O===4H++2Br-+SO![]() 分液漏斗 溴化钾(或其他含Br-的盐类物质) 温度过高,大量水蒸气被蒸出,溴蒸气中水增加;温度过低,溴不能完全蒸出,产率低
分液漏斗 溴化钾(或其他含Br-的盐类物质) 温度过高,大量水蒸气被蒸出,溴蒸气中水增加;温度过低,溴不能完全蒸出,产率低
【解析】分析:海水中通入氯气把溴离子氧化为单质溴,然后利用空气吹出,得到含溴的空气,利用二氧化硫的还原性把溴还原为溴离子,再次利用氯气把溴离子氧化为单质溴,最后蒸馏得到液溴,据此解答。
详解:(1)步骤③中二氧化硫把溴单质还原为溴离子,反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离方法是分液,因此分离仪器的名称是分液漏斗。
(3)氯气具有强氧化性,能把溴离子氧化为单质溴,因此在步骤⑤中可将蒸馏产生的气体通过溴化钾溶液,以除去氯气。
(4)由于温度过高,大量水蒸气被蒸出,溴蒸气中水增加;温度过低,溴不能完全蒸出,产率低,因此步骤⑤的蒸馏过程中,温度应控制在80~90℃。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列关于生物体内化合物的说法不正确的是( )
A. 脂肪是既能贮能又具有保温作用的物质
B. 蛋白质是控制细胞生命活动的大分子
C. 无机盐离子可以维持内环境的渗透压
D. 核酸承担了遗传信息贮存和传递的任务
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚。

已知:
回答下列问题:
(1)写出A→B反应所需的试剂____________, A→B反应类型为__________。
(2)对于柳胺酚,下列说法正确的是________。
A.1 mol柳胺酚最多可以和2 mol NaOH反应 B.可发生水解反应
C.不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式___________________________________________。
(4)写出化合物F的结构简式______________________
(5)写出同时符合下列条件的F的同分异构体的结构简式_____________________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。_______________________
注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为: CO(g)+2H2(g)CH3OH(g)△H<0按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
A.平衡常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平均摩尔质量:M(a)<M(c),M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学基本概念的说法正确的是
A.在水溶液中能电离出H+的化合物是酸
B.溶液与胶体的本质区别:分散质颗粒的直径大小
C.纯净物与混合物的区别:是否仅含有一种元素
D.根据不同的物质分类标准,纯碱可归类为碱、钠盐、碳酸盐等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明的酸性溶液中能大量共存的离子组是
A.K+、HCO3-、Cl-B.Fe2+、Cu2+、SO42-
C.Na+、SO42-、ClO-D.Mg2+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置做相应实验,收集方法及所加试剂、现象、结论均正确的是
选项 | 气体 | 试剂 | 现象 | 结论 |
|
A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 气体 | |
B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
C | NO2 | 淀粉一KI溶液 | 溶液变蓝色 | NO2有还原性 | |
D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: 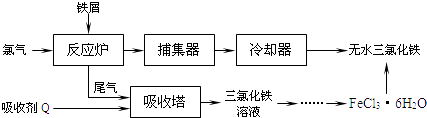
(1)试写出吸收塔中反应的离子方程式: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39).
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c molL﹣1 Na2S2O3溶液滴定用去V mL.(已知:I2+2S2O32﹣═2I﹣+S4O62﹣) ①滴定终点的现象是: .
②求样品中氯化铁的质量分数(写出计算过程) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 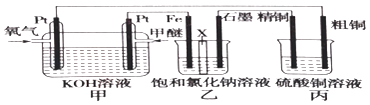
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com