
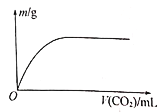
【题目】W、X、Y、Z为原子序数依次增大的四种短周期元素,其中两种为非金属元素。W的气态氢化物遇到其最高价氧化物对应的水化物产生“白烟”,Z的最外层电子数等于其电子层数的2倍,W和X的最外层电子数之和等于Z的族序数。在含X和Y的可溶性盐溶液中通入过量的CO2,产生沉淀的质量与CO2体积的关系如图所示。下列说法正确的是
A. 简单离子半径:X>Y>Z>W
B. Z的氧化物对应的水化物均为强酸
C. 含Y的阴离子溶液与含Y的阳离子溶液能够发生反应
D. 工业上可用电解法或热还原法制备X和Y的单质
【答案】C
【解析】
NH3遇HNO3会生成白色固体,产生“白烟",W为氮元素;短周期元素中,原子的最外层电子数等于电子层数2倍的元素有C、S元素,Z的原子序数大于7,所以Z为硫元素;又因为W和X的最外层电子数之和等于Z的最外层电子数,所以X为钠元素;由图知,通入CO2产生沉淀。且沉淀不溶于过量的CO2,NaAlO2、Na2SiO3溶液中通入CO2产生沉淀,且硅酸、氢氧化铝不溶于CO2,但四种元素中有两种非金属元素,故Y为铝元素,不是硅元素,据此分析。
NH3遇HNO3会生成白色固体,产生“白烟",W为氮元素;短周期元素中,原子的最外层电子数等于电子层数2倍的元素有C、S元素,Z的原子序数大于7,所以Z为硫元素;又因为W和X的最外层电子数之和等于Z的最外层电子数,所以X为钠元素;由图知,通入CO2产生沉淀。且沉淀不溶于过量的CO2,NaAlO2、Na2SiO3溶液中通入CO2产生沉淀,且硅酸、氢氧化铝不溶于CO2,但四种元素中有两种非金属元素,故Y为铝元素,不是硅元素。
A、S2-、N3-、Na+、Al3+的离子半径依次减小,选项A错误;
B、硫的含氧酸有H2SO3、H2SO4,H2SO3是弱酸,选项B错误;
C、含Al3+和AlO2-的溶液能够发生反应生成氢氧化铝沉淀,选项C正确;
D、工业上可以采用电解法制备钠、铝,但是不能用热还原法制备。选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g) +B(g) ![]() xC(g) +2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g) +2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于_________;
(2)A的转化率为____________;
(3)生成D的反应速率为_________________;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 Urolithin A常用于合成某药物,其结构简式如图所示。下列说法错误的是
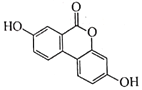
A. Urolithin A分于中苯环上的一氯代物有6种
B. Urolithin A分子中所有原子不可能共平面
C. Urolithin A能发生加成、取代和氧化反应
D. Urolithin A在稀硫酸中的水解产物含2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。

(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com