
| 81��10-18 |
| Ksp |
| [Fe2+] |
| 8.1��10-17 |
| 1 |
|


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
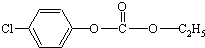 ��������NaOH��Һ��Ϲ��ȣ���ַ�Ӧ����������NaOH�����ʵ����ǣ�������
��������NaOH��Һ��Ϲ��ȣ���ַ�Ӧ����������NaOH�����ʵ����ǣ�������| A��3mol | B��4mol |
| C��5mol | D��6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2-��-4-�һ����� |
| B��3��4��4-�������� |
| C��2��3-���һ�-1-��ϩ |
| D������ױ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2K+2H2O=2KOH+H2�� | |||
| B��2Na+2C2H5OH��2C2H5ONa+H2�� | |||
| C��Na2CO3+H2O=NaHCO3+NaOH | |||
D��CH3COOH+CH3CH2OH
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��Na+����c��CH3COO-����c��H+����c��OH-�� |
| B��c��CH3COO-����c��Na+����c��H+����c��OH-�� |
| C��c��CH3COO-����c��Na+����c��OH-����c��H+�� |
| D��c��Na+��+c��H+����c��OH-��+c��CH3COO-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��20% | B��20%��60% |
| C��60% | D������60% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�17g-14CH3������������Ϊ9NA |
| B��39g�ط���������ԭ��Ӧʱ��һ��ʧȥNA������ |
| C����״��ʱ��22.4L���ȼ��������еķ�����ΪNA |
| D�����³�ѹ�£�1mol�������еĺ��������Ϊ 4NA |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com