
【题目】Ⅰ.在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________色,因为___________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈___________色,因为_______________。
Ⅱ.将CoCl2溶于浓盐酸中能形成CoCl42—。溶液中存在如下平衡:CoCl42-(蓝色) + 6H2O![]() Co(H2O)62+(粉红色)+ 4Cl-
Co(H2O)62+(粉红色)+ 4Cl-
(3)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为___________反应(填“吸热”或“放热”)。
(4)该反应平衡常数表达式为______________________,加水稀释平衡向____________方向(填“正”或“逆”)移动。
(5)向溶液中加入少量AgNO3固体,溶液颜色变为_______色。
【答案】黄 中和H+平衡向正反应方向移动 橙红色 增加生成物浓度平衡向逆反应方向移动 放热 K = c[Co(H2O)62+]c4[Cl—]/ c[CoCl42—] 正 粉红色。
【解析】
(1)向上述溶液中加入NaOH溶液后,溶液中OH-浓度增大,中和氢离子,降低氢离子的浓度。则根据Cr2O72—+H2O![]() 2CrO42—+2H+,可知,平衡向正反应方向移动,所以溶液呈黄色;(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,增加生成物c(H+),平衡向逆反应方向移动因此溶液呈橙红色;(3)盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则上述平衡逆向移动,即升高温度平衡逆向移动,则正反应为放热反应,故答案为:放热;(4)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=
2CrO42—+2H+,可知,平衡向正反应方向移动,所以溶液呈黄色;(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,增加生成物c(H+),平衡向逆反应方向移动因此溶液呈橙红色;(3)盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则上述平衡逆向移动,即升高温度平衡逆向移动,则正反应为放热反应,故答案为:放热;(4)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=![]() ,加水稀释促进水解,即稀释平衡正向移动;(5)加入少量AgNO3固体,与氯离子反应生成沉淀,使上述平衡正向移动,Co(H2O)62+浓度增大,溶液为粉红色。
,加水稀释促进水解,即稀释平衡正向移动;(5)加入少量AgNO3固体,与氯离子反应生成沉淀,使上述平衡正向移动,Co(H2O)62+浓度增大,溶液为粉红色。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cl2O常温下为气态,溶于水可得只含单一溶质A的弱酸性溶液,且有漂白性,A溶液在放置过程中其酸性会增强。常温下,Cl2O与NH3反应生成离子化合物B、气体单质C和常见液体D,C为空气中含量最多的物质。请回答下列问题:
(1)B的化学式为_______,气体单质C的结构式为_________。
(2)用化学方程式表示A溶液酸性增强的原因______。
(3)A溶液能使紫色石蕊溶液褪色,体现了A具有____性。
(4)固体B与碱共热能生成一种刺激性气味的气体,该气体是_____(填“离子” 或“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)实验方案中②③④步通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入试剂不合理的顺序是(_____)
A.c b a
B.b c a
C.b a c
D.c a b
(2)如图是中学化学中常用于混合物的分离和提纯的装置,该实验方案中:

(1)在第⑤步操作中要用到的装置是图中的___(填字母),玻璃棒的作用是___;
(2)第⑦步操作的名称是___,所用到的实验装置是上图中的___(填字母),其中用于盛放溶液的仪器名称是___;
(3)检验SO42-是否除尽的操作方法是________;
(4)为提高精盐的产率,第⑤步操作后应对沉淀加以洗涤,请简要描述洗涤的方法是:___;
(5)写出第⑥步可能发生的化学反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
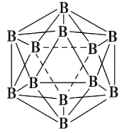
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
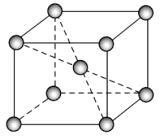
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出121kJ的能量,且氧气中1molO=O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )
A. 920kJB. 557kJC. 436kJD. 181kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合ⅦA族元素性质特征的是( )
A. 从上到下元素的非金属性增强
B. 除F外其他元素最高价氧化物对应的水化物可表示为HXO4(X指卤族元素)
C. 单质的熔沸点逐渐升高
D. 单质都能与H2直接化合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com